题目内容
6.在标准状况下,11.2L某气体(AO2)的质量是32g,其中原子A的中子数和质子数相等.求:(1)A的原子量和核内质子数各是多少?A是什么元素?
(2)若要使AO2还原为A的单质,应将AO2与何种气体混和反应?在反应中,AO2是氧化剂还是还原剂?
分析 (1)n(AO2)=$\frac{11.2L}{22.4/mol}$=0.5mol,M(AO2)=$\frac{32g}{0.5mol}$=64g/mol,以此可计算M(A),并确定元素种类;
(2)若要使AO2还原为A的单质,A元素化合价降低,被还原,应加入还原剂才能实现.
解答 解:(1)n(AO2)=$\frac{11.2L}{22.4/mol}$=0.5mol,M(AO2)=$\frac{32g}{0.5mol}$=64g/mol,则A的相对原子质量为64-32=32,原子A的中子数和质子数相等,则质子数为16,为S元素,
答:A的原子量和核内质子数各是32、16,A是S元素;
(2)若要使SO2还原为S的单质,S元素化合价降低,被还原,为氧化剂,可与H2S反应,
答:若要使AO2还原为A的单质,应将AO2与H2S混和反应,在反应中,AO2是氧化剂.
点评 本题综合考查氧化还原反应以及物质的量的相关计算,侧重于学生的分析、计算能力的考查,难度不大,注意把握计算公式的运用.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
17.常温下,一元酸HA溶液和NaOH溶液等体积混合(忽略体积变化),实验数据如下表下列判断正确的是( )
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | X | 0.2 | 7 |
| ③ | 0.2 | 0.1 | 4.8 |
| ④ | 0.1 | 0.2 | y |
| A. | 实验①反应后的溶液中:c(HA)约为$\frac{{K}_{W}}{1×1{0}^{-9}}$mol•L-1 | |
| B. | 实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| C. | 实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-) | |
| D. | 实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05mol•L-1 |
14.NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 常温常压下,8 g O2与8 g O3均含有4 NA个电子 | |
| B. | 标准状况下,2.24 L SO3的分子数为0.1 NA | |
| C. | 1L 1mol•L-1盐酸中含有NA个HCl分子 | |
| D. | 0.1 mol Fe与足量浓HNO3反应,转移电子数为0.3 NA |
1.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 化合物AE与CE有相同类型的化学键 |
18.W、X、Y、Z四种元素是原子序数依次增大的短周期主族元素,已知:①四种元素的电子层数之和等于10,且它们是连续的四种主族元素;②四种元素的原子,其半径最大的是X原子.下列说法正确的是( )
| A. | W和X均位于第二周期 | B. | Y和Z分别是Al和Si | ||
| C. | W和X分别是O和F | D. | Z的金属性可能比X强 |
13.某化合物6.2g在O2中完全燃烧,只生成8.8g CO2和5.4g H2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:2 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
 .
.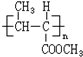 和高聚物H的合成路线如图:
和高聚物H的合成路线如图: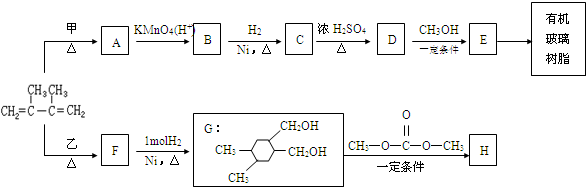
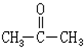 +CH3COOH
+CH3COOH
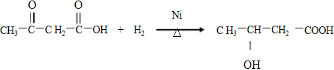 .
. .
.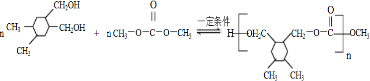 +(2n-1)CH3OH.
+(2n-1)CH3OH.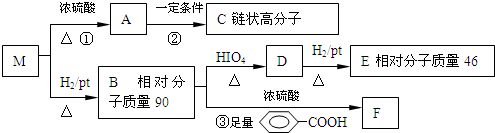
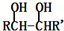 $→_{△}^{HIO_{4}}$RCHO+OHR′
$→_{△}^{HIO_{4}}$RCHO+OHR′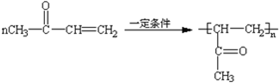 ;
;