题目内容
5.下列各溶液中,微粒的物质的量浓度关系正确的是( )| A. | NaHSO3溶液:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>C(OH-) | |
| C. | 氯气溶于水达到平衡后,若其他条件不变加入CaCO3固体,$\frac{c({H}^{+})}{c(HClO)}$增加 | |
| D. | NaSiO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
分析 A、电荷守恒:2c(SO32-)+c(HSO3-)+c(OH-)=(H+)+c(Na+)①,由物料守恒可知c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+)②,以此计算;
B、CuSO4•(NH4)2SO4•6H2O的溶液中,电离出的铵根离子浓度大约是铜离子浓度的2倍,硫酸根离子不水解,铜离子和铵根离子会发生水解导致溶液显示酸性;
C、原平衡为:Cl2+H2O?H++Cl-+HClO,加入CaCO3固体后,氢离子浓度减小,平衡正向移动,次氯酸的浓度变大;
D、NaSiO3溶液加水稀释后,促进水解,但浓度变小,所以PH变小,恢复至原温度,KW是温度的函数.
解答 解:A、电荷守恒:2c(SO32-)+c(HSO3-)+c(OH-)=(H+)+c(Na+)①,由物料守恒可知c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+)②,②代入①,得c(SO32-)+c(OH-)=c(H+)+c(H2SO3),故A错误;
B、CuSO4•(NH4)2SO4•6H2O的溶液中,电离出的铵根离子浓度大约是铜离子浓度的2倍,硫酸根离子不水解,铜离子和铵根离子会发生水解导致溶液显示酸性,所以离子浓度大小为:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>C(OH-),故B正确;
C、原平衡为:Cl2+H2O?H++Cl-+HClO,加入CaCO3固体后,氢离子浓度减小,平衡正向移动,次氯酸的浓度变大,所以$\frac{c({H}^{+})}{c(HClO)}$减小,故C错误;
D、NaSiO3溶液加水稀释后,促进水解,但浓度变小,所以PH变小,恢复至原温度,KW不变,故D错误;
故选B.
点评 本题考查了离子浓度的大小比较,化学平衡的移动、水解平衡等,注意次氯酸是一种弱电解质,在加入碳酸钙固体时,氢离子浓度减小,平衡正向移动,然后分析比值的大小,综合性强,有一定难度.

 阅读快车系列答案
阅读快车系列答案| A. | 元素X有三种同位素 | |
| B. | 其中一种同位素质量数为36 | |
| C. | 质量数为35的同位素原子的质量分数为75% | |
| D. | 元素单质X2的平均式量为71 |
 )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
| A. | M能使酸性高锰酸钾溶液褪色 | |
| B. | 1 mol磷酸吡醛与足量的金属钠反应,最多消耗2mol Na | |
| C. | 1 mol磷酸吡醛与NaOH溶液反应,最多消耗4mol NaOH | |
| D. | M与足量H2反应后所得有机物的分子式为C8H17O3N |
| A. | 27gAl与足量浓硫酸混合,产生气体33.6L(标况) | |
| B. | 1molSiO2与C完全反应,生成标准状况气体44.8L | |
| C. | 电解精炼Cu时,阳极每溶解12.8gCu,阴极析出0.2molCu | |
| D. | 1mol/L的某一元酸溶液,测得pH=3,溶液中c(OH-)一定为1×10-11 |
| A. | 2:3 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | X | 0.2 | 7 |
| ③ | 0.2 | 0.1 | 4.8 |
| ④ | 0.1 | 0.2 | y |
| A. | 实验①反应后的溶液中:c(HA)约为$\frac{{K}_{W}}{1×1{0}^{-9}}$mol•L-1 | |
| B. | 实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| C. | 实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-) | |
| D. | 实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05mol•L-1 |
| A. | 常温常压下,8 g O2与8 g O3均含有4 NA个电子 | |
| B. | 标准状况下,2.24 L SO3的分子数为0.1 NA | |
| C. | 1L 1mol•L-1盐酸中含有NA个HCl分子 | |
| D. | 0.1 mol Fe与足量浓HNO3反应,转移电子数为0.3 NA |
 .
.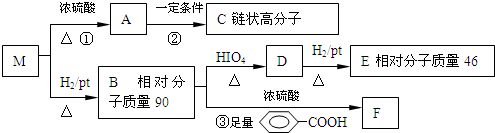
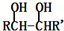 $→_{△}^{HIO_{4}}$RCHO+OHR′
$→_{△}^{HIO_{4}}$RCHO+OHR′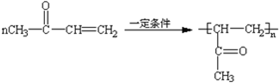 ;
;