题目内容
4.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).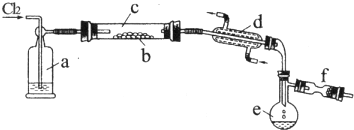
(1)仪器名称:d直形冷凝管(或冷凝管),e蒸馏烧瓶
(2)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式
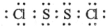 .
.(3)装置a中应放试剂为浓H2SO4,装置C为何水平放置?防止熔融的硫堵塞导管.
(4)f装置中应放置的试剂为碱石灰,其作用为吸收Cl2尾气,并防止空气中的水汽使S2Cl2水解.
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
分析 (1)根据仪器的形状确定名称;
(2)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对;
(3)由信息可知S2Cl2遇水水解,进入b中的气体应该干燥.硫的熔点较低,加热容易融化,防止熔融的硫堵塞导管.管.d为冷凝管,使生成的S2Cl2冷凝成液体;
(4)F装置盛放碱石灰,吸收Cl2尾气,防止空气中的水汽加入e中;
(5)只有硫元素化合价发生变化.
解答 解:(1)d为冷凝管,e为蒸馏烧瓶,故答案为:直形冷凝管(或冷凝管);蒸馏烧瓶;
(2)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对,S2Cl2电子式为 ,故答案为:
,故答案为: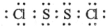 ;
;
(3)由信息可知S2Cl2遇水水解,进入b中的气体应该干燥.用浓硫酸干燥,a中应放试剂为浓硫酸,其作用为干燥氯气;
硫的熔点较低,加热容易融化,装置c水平放置防止熔融的硫堵塞导管,故答案为:浓H2SO4;防止熔融的硫堵塞导管;
(4)F装置盛放碱石灰,吸收Cl2尾气,防止污染环境,防止空气中的水汽加入e中使S2Cl2水解,故答案为:碱石灰;吸收Cl2尾气,并防止空气中的水汽使S2Cl2水解;
(5)只有硫元素化合价发生变化,且被氧化和被还原的物质的量之比为1:3,化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故答案为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
点评 本题考查学生对实验原理及装置的理解、评价,阅读题目获取信息的能力等,关键是掌握整个制备流程原理,分析流程中各装置的作用,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,难度中等.

练习册系列答案
相关题目
8.下列解释事实的方程式不正确的是( )
| A. | 测0.01mol/L的醋酸的pH为5:CH3COOH?CH3COO-+H+ | |
| B. | 电解饱和食盐水,产生气体:2Cl-+2H2O$\frac{\underline{\;高温\;}}{\;}$Cl2↑+2OH-+H2↑ | |
| C. | 铁放在氧气中燃烧,产生黑色固体:4Fe+3O 2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | |
| D. | 硫酸钙与碳酸钠溶液,产生白色沉淀:CaSO4(S)+CO32-?CaCO3(S)+SO42- |
9.某元素X构成的双原子单质分子有三种,其式量分别为70、72、74,在天然单质中,此三种单质的物质的量之比为9:6:1.推断以下结论中正确的是( )
| A. | 元素X有三种同位素 | |
| B. | 其中一种同位素质量数为36 | |
| C. | 质量数为35的同位素原子的质量分数为75% | |
| D. | 元素单质X2的平均式量为71 |
13.已知吡啶( )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )

 )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
| A. | M能使酸性高锰酸钾溶液褪色 | |
| B. | 1 mol磷酸吡醛与足量的金属钠反应,最多消耗2mol Na | |
| C. | 1 mol磷酸吡醛与NaOH溶液反应,最多消耗4mol NaOH | |
| D. | M与足量H2反应后所得有机物的分子式为C8H17O3N |
14.NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 常温常压下,8 g O2与8 g O3均含有4 NA个电子 | |
| B. | 标准状况下,2.24 L SO3的分子数为0.1 NA | |
| C. | 1L 1mol•L-1盐酸中含有NA个HCl分子 | |
| D. | 0.1 mol Fe与足量浓HNO3反应,转移电子数为0.3 NA |

 .
.