题目内容
【题目】某小组取一定质量的FeSO4固体,利用下图装置进行实验.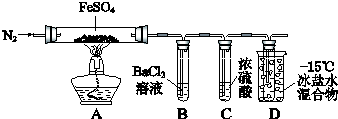
实验过程 | 实验现象 | |
① | 通入一段时间N2 , 加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2 熔点﹣72℃,沸点﹣10℃;SO3熔点16.8℃,沸点44.8℃.
(1)实验③反应的离子方程式是 .
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有气体,依据是 .
(3)实验④反应的离子方程式是 .
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成.你认为是否正确,原因是(用必要的文字和化学方程式解释)
【答案】
(1)Fe2O3+6H+=2Fe3++3H2O
(2)SO2;因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原.因此一定有SO2生成
(3)2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+
(4)不正确,因为分解有O2和SO2生成,在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4 , 故无论分解反应是否有SO3生成,都会有此现象,2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl.
【解析】解:(1)根据②木条复燃说明有氧气生成,根据A中固体变为红棕色,说明A中固体变为红棕色为氧化铁,B中有白色沉淀为硫酸钡,是因为硫酸亚铁在氮气的条件下隔绝空气加热分解生成氧化铁、二氧化硫,所以实验③反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;(2)根据氧化还原反应的特点,元素化合价升高的价数等于元素化合价降低的价数,分解过程除产生使木条复燃的气体为氧气说明氧元素的化合价在升高,A中固体变为红棕色为氧化铁,因为有Fe2O3生成,铁的化合价也在升高,在FeSO4中只有+6价S元素有氧化性,能被还原,因此一定有SO2生成,故答案为:SO2;因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原.因此一定有SO2生成;(3)取A中固体,加盐酸Fe2O3+6HCl=2FeCl3+3H2O,将③所得溶液滴入D试管中,溶液变为浅绿色说明有二价铁生成,说明三价铁离子被还原,D试管中有无色液体为二氧化硫,发生的反应为2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ , 故答案为:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;(4)因为硫酸亚铁在氮气的条件下隔绝空气加热分解一定生成氧化铁、二氧化硫,不一定有三氧化硫,B中的现象是有白色沉淀生成,白色沉淀为硫酸钡,该沉淀可能是2SO2+O2+2H2O=2H2SO4 , H2SO4+BaCl2=BaSO4↓+2HCl,故无论分解反应是否有SO3 生成,都会有此现象,总反应为2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl,故答案为:不正确,因为分解有O2 和SO2 生成,在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4 , 故无论分解反应是否有SO3 生成,都会有此现象;2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl.(1)A中固体变为红棕色为氧化铁;然后加盐酸,是氧化铁和盐酸反应,据此书写离子反应方程式;(2)分解过程除产生使木条复燃的气体为氧气,A中固体变为红棕色为氧化铁,因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原,因此一定有SO2生成;(3)A为氧化铁加盐酸生成三价铁离子,将③所得溶液滴入D试管中,溶液变为浅绿色说明有二价铁生成,所以三价铁离子和二氧化硫发生了氧化还原反应,据此解答;(4)FeSO4分解不一定有SO3生成,B中的现象是有白色沉淀生成,可能是在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4 , H2SO4+BaCl2=BaSO4↓+2HCl,故无论分解反应是否有SO3 生成,都会有此现象,据此解答.

