��Ŀ����
����Ŀ���ö������ȣ�ClO2���������ƣ�Na2FeO4Ħ������Ϊ166g/mol�������;�ˮ�������ͳ�ľ�ˮ��Cl2�Ե�ˮ���������dz�������ˮ�����¼�����ClO2��Na2FeO4��ˮ���������зֱ𱻻�ԭΪCl����Fe3+ ��
��1������Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ���ô��ClO2��Na2FeO4��Cl2��������ɱ����������Ч���ɴ�С��˳�������� ��
��2��Na2FeO4����ˮ��ų�һ����ɫ��ζ���壬��ɱ������������ˮ�е��������ʵ�ԭ���������ӷ���ʽ��ʾΪ ��
��3����ҵ��CH3OH��NaClO3Ϊԭ����������������ȡClO2 �� ͬʱ����CO2���壬��֪�÷�Ӧ��Ϊ�������У���һ��Ϊ2ClO3��+2Cl��+4H+=2ClO2��+Cl2��+2H2O����д���ڶ�����Ӧ�����ӷ���ʽ ��
�ڹ�ҵ����ʱ���ڷ�Ӧ���м�����Cl�� �� �������� ��
�������лᷢ������ӦClO3��+Cl��+H+��Cl2��+H2O��δ��ƽ��������÷�Ӧ��Ļ��������Cl2���������Ϊ3/73������ʼͶ��ʱCH3OH��NaClO3�����ʵ���֮��Ϊ ��
��4����֪����������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ��59�棬�е�Ϊ11.0�棬������ˮ��ClO2Ҳ���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ�����60��ʱ��Ӧ�Ƶã�ijѧ������ͼ��ʾ��װ��ģ�ҵ��ȡ���ռ�ClO2 �� ����AΪClO2�ķ���װ�ã�BΪClO2������װ�ã�CΪβ������װ�ã����ʣ���A���ֻ�Ӧ�����¶ȿ��ƣ���ˮԡ���ȣ�װ�ã�B���ֻ�Ӧ����ʲôװ����
��C��Ӧװ���Լ�Ϊ �� C�з�����Ӧ�Ļ�ѧ����ʽΪ�� �� 
���𰸡�
��1��ClO2��Cl2��Na2FeO4
��2��4FeO42��+10H2O=4Fe��OH��3+8OH��+3O2��
��3��CH3OH+3Cl2+H2O=6Cl��+CO2+6H+��������1��6.1
��4������ˮ��������NaOH��Һ��2ClO2+2NaOH=NaClO2+NaClO3+H2O
���������⣺��1��ClO2��Na2FeO4��Cl2��������ɱ����������Ч�ʷֱ���ClO2��67.5g��5mol=13.5g/mol��Na2FeO4��166g��3mol=55.33g/mol��Cl2��71g/2mol=35.5g/mol��������������ɱ����������Ч���ɴ�С��˳����ClO2��Cl2��Na2FeO4���ʴ�Ϊ��ClO2��Cl2��Na2FeO4����2����������ɵ�Na2FeO4��H2O����ΪO2 �� ����ɱ������������������ԭΪFe3+ �� Fe3+ˮ�����Fe��OH��3��������ˮ�е��������ʣ��Ӷ�������ˮ���÷�Ӧ�����ӷ���ʽΪ��4FeO42��+10 H2O=4Fe��OH��3+8OH��+3O2�����ʴ�Ϊ��4FeO42��+10 H2O=4Fe��OH��3+8OH��+3O2������3���ټ״���������ˮ��Һ�з���������ԭ��Ӧ�����Ȼ���Ͷ�����̼�����Եڶ�����Ӧ�����ӷ���ʽΪ��CH3OH+3Cl2+H2O=6Cl��+CO2+6H+���ʴ�Ϊ��CH3OH+3Cl2+H2O=6Cl��+CO2+6H+�����ɢ��е�������Ӧ����ʽ���Կ�����ת����ͬ�ĵ��ӣ�Cl�����������������ȣ�֮�����ڹ�ҵ����ʱҪ�ڷ�Ӧ���м�����Cl�� �� ����ΪCl�������������ã��ʴ�Ϊ���������۽���һ����ڶ����ķ���ʽ���ӿɵ��ܷ���ʽ��6ClO3��+CH3OH+6H+=CO2��+6ClO2��+5H2O��������ӦClO3��+Cl��+H+��Cl2��+H2O��ƽ�ɵã�ClO3��+5Cl��+6H+=3Cl2��+3H2O����÷�Ӧ��Ļ��������Cl2���������Ϊ3/73����������������ʵ���Ϊ73mol����Cl2Ϊ3mol��CO2��ClO2�����ʵ���Ϊ70mol������3mol��Cl2����NaClO3�����ʵ���1mol�����ݷ���ʽ6ClO3��+CH3OH+6H+=CO2��+6ClO2��+5H2O��֪����CO2��ClO2�����ʵ���Ϊ70mol����CH3OH�����ʵ���Ϊ10mol������ NaClO3�����ʵ���Ϊ60mol�����Թ�����CH3OH�����ʵ���Ϊ10mol������ NaClO3�����ʵ���Ϊ60mol+3mol=61mol�������ʼͶ��ʱCH3OH��NaClO3�����ʵ���֮��Ϊ10��61=1��6.1��
�ʴ�Ϊ��1��6.1����4������ΪClO2�ķе�ͣ����ӷ�������B���ֻ�Ӧ�����װ��������װ�ã������ñ�ˮ���н��£��ʴ�Ϊ������ˮ����������CΪβ������װ�ã�����ClO2��������Ӧ������ͨ����NaOH��Һ�����գ���Ӧ�ķ���ʽΪ��2ClO2+2NaOH=NaClO2+NaClO3+H2O���ʴ�Ϊ��2ClO2+2NaOH=NaClO2+NaClO3+H2O��
��1������ȡ1molClO2��Cl2��Na2FeO4 �� �ֱ������������ԭ��Ӧ��Ԫ�ػ��ϼ۱仯��Ŀ�жϽ�𣻣�2��Na2FeO4��H2O����ΪO2 �� ����ɱ������������������ԭΪFe3+ �� Fe3+ˮ�����Fe��OH��3��������ˮ�е��������ʣ��Ӷ�������ˮ���ݴ�д����Ӧ�����ӷ���ʽ����3���ټ״���������ˮ��Һ�з���������ԭ��Ӧ�����Ȼ���Ͷ�����̼�����ɢ��е�������Ӧ����ʽ���Կ�����ת����ͬ�ĵ��ӣ�Cl�����������������ȣ���ϴ����ĸ����𣻢۽���һ����ڶ����ķ���ʽ���ӿɵ��ܷ���ʽ��6ClO3��+CH3OH+6H+=CO2��+6ClO2��+5H2O��������ӦClO3��+Cl��+H+��Cl2��+H2O��ƽ�ɵã�ClO3��+5Cl��+6H+=3Cl2��+3H2O����÷�Ӧ��Ļ��������Cl2���������Ϊ3/73����������������ʵ���Ϊ73mol����Cl2Ϊ3mol��CO2��ClO2�����ʵ���Ϊ70mol������3mol��Cl2����NaClO3�����ʵ���1mol�����ݷ���ʽ6ClO3��+CH3OH+6H+=CO2��+6ClO2��+5H2O��֪����CO2��ClO2�����ʵ���Ϊ70mol����CH3OH�����ʵ���Ϊ10mol������ NaClO3�����ʵ���Ϊ60mol���ݴ˼����𣻣�4��������ClO2�ķе�ͣ����ӷ������ʽ��
��CΪβ������װ�ã�����ClO2��������Ӧ������ͨ����NaOH��Һ�����գ����߷�Ӧ����NaClO2��NaClO3��H2O��

����Ŀ��ijС��ȡһ��������FeSO4���壬������ͼװ�ý���ʵ�飮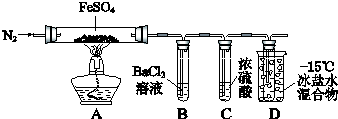
ʵ����� | ʵ������ | |
�� | ͨ��һ��ʱ��N2 �� ���� | A�й����Ϊ����ɫ��B���а�ɫ������D�Թ�������ɫҺ�� |
�� | �ô��л��ǵ�ľ������װ��D�ĵ��ܿ� | ľ����ȼ |
�� | ��ַ�Ӧ��ֹͣ���ȣ���ȴ��ȡA�й��壬������ | �����ܽ⣬��Һ�ʻ�ɫ |
�� | ����������Һ����D�Թ��� | ��Һ��Ϊdz��ɫ |
��֪��SO2 �۵㩁72�棬�е㩁10�棻SO3�۵�16.8�棬�е�44.8�森
��1��ʵ��۷�Ӧ�����ӷ���ʽ�� ��
��2���ֽ���̳�����ʹľ����ȼ�������⣬����A�й�����ɫ�仯�Ʋ⣬��һ�������壬������ ��
��3��ʵ��ܷ�Ӧ�����ӷ���ʽ�� ��
��4��ijͬѧ����B�е�������ΪFeSO4�ֽ�һ����SO3���ɣ�����Ϊ�Ƿ���ȷ��ԭ���ǣ��ñ�Ҫ�����ֺͻ�ѧ����ʽ���ͣ�
����Ŀ����ѧ����������������Ϊ�Ҵ���ˮ����ϩ�Ĵ������������ʵ�飮�������ʾ�����ͷ�Ӧ����������ƿ�м���һ����P2O5 �� ��ע��95%���Ҵ��������ȣ��۲�����
ʵ�� | P2O5/g | 95%�Ҵ���/mL | ���ȷ�ʽ |
ʵ��1 | 2 | 4 | �ƾ��� |
ʵ��2 | 2 | 4 | ˮԡ70�� |
ʵ�������£�
ʵ�� | ʵ������ | ||
����ƿ | �ռ�ƿ | �Թ� | |
ʵ��1 | �ƾ�����ʱ�����̲������������þƾ��Ƽ���ʱ�������ݲ����������ڣ�������״Һ�� | ����ɫҺ�� | ��Һ��ɫ |
ʵ��2 | �ƾ�����ʱ�����̲�������������ˮԡ����ʱ�����������ݣ�һ��ʱ���Ӧƿ��������״Һ�� | ����ɫҺ�� | ��Һ����ɫ |
�����������ϣ����������գ�
��1��д��ʵ�������Ҵ�����ϩ�Ļ�ѧ����ʽ�� ��
��2����ͼװ���������ܵ�������
��3��ʵ��1ʹ������Ȼ�̼��Һ��ɫ����������д�ṹ��ʽ��
��4������ʵ��1��2�����ƶϣ�����P2O5��Ϊ���������ϩ�ķ�Ӧ������
��P2O5��95%�Ҵ���ˮԡ70����������£�����ƿ���ռ�ƿ�е�Һ�徭����Ϊ���������������Է������л���Ӧ����������Ӧ��
����Ŀ��ijʵ��С����������KMnO4��H2C2O4��Ӧͨ���ⶨ��λʱ�������� CO2������̽��Ӱ�췴Ӧ���ʵ����أ����ʵ�鷽�������
ʵ����� | A ��Һ | B ��Һ |
�� | 20 mL 0.1 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1KMnO4 ������Һ |
�� | 20 mL 0.2 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1 KMnO4������Һ |

��1��������ͼװ�������Ե����㷽��Ϊ�� ��
��2��H2C2O��Һ������ KMnO4��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʵ��̽���������ضԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ͬʱ������Ͳ������CO2�������С��ϵ������ʵ����ţ���
��4����ʵ�����2minĩ�ռ���4.48mL CO2����״���£�������2minĩ��c��MnO4����=����������Һ���ǰ������ı仯����
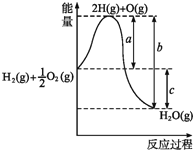
��5��С��ͬѧ���ַ�Ӧ����������ͼ��ʾ������̽��t1��t2ʱ�������ʱ�����Ҫԭ�������������ǣ�����������K+�Ը÷�Ӧ�д����ã�