��Ŀ����
����Ŀ������25��ʱ0.1mol/L�İ�ˮ����ش��������⣺
��1������ˮ�м�����������粒��壬��ʱ��Һ�� ![]() �����������С�����䡱����
�����������С�����䡱����
��2������ˮ�м���ϡ���ᣬʹ��ǡ���кͣ�д����Ӧ�����ӷ���ʽ��������Һ��pH7�����������������=�����������ӷ���ʽ��ʾ��ԭ����
��3������ˮ�м���ϡ��������Һ��pH=7����ʱc��NH4+��=amol/l����c��SO ![]() ��=��
��=��
��4������ˮ�м���pH=1�����ᣬ�Ұ�ˮ������������Ϊ1��1����������Һ�и��������ʵ���Ũ���ɴ�С�Ĺ�ϵ�� ��
���𰸡�
��1����С
��2��NH3 �� H2O+H+=NH ![]() +H2O������NH
+H2O������NH ![]() +H2O?NH3 �� H2O+H+
+H2O?NH3 �� H2O+H+
��3��0.5amol/l
��4��c��NH ![]() ����c��SO
����c��SO ![]() ����c��H+����c��OH����
����c��H+����c��OH����
���������⣺��1�����ڣ�NH4��2SO4=2NH ![]() +SO
+SO ![]() ����Һ��NH
����Һ��NH ![]() Ũ���������ư�ˮ���룬������Һ������������Ũ�ȼ�С����ˮ����Ũ���������Դ�ʱ��Һ��
Ũ���������ư�ˮ���룬������Һ������������Ũ�ȼ�С����ˮ����Ũ���������Դ�ʱ��Һ�� ![]() ��С�����Դ��ǣ���С����2������Ͱ�ˮ��Ӧ��������狀�ˮ�����ӷ�Ӧ����ʽΪNH3 �� H2O+H+=NH
��С�����Դ��ǣ���С����2������Ͱ�ˮ��Ӧ��������狀�ˮ�����ӷ�Ӧ����ʽΪNH3 �� H2O+H+=NH ![]() +H2O���������ǿ��������ˮ���ʹ����Һ�����ԣ�ˮ�ⷽ��ʽΪ��NH
+H2O���������ǿ��������ˮ���ʹ����Һ�����ԣ�ˮ�ⷽ��ʽΪ��NH ![]() +H2ONH3 �� H2O+H+�����Դ��ǣ�NH3 �� H2O+H+=NH
+H2ONH3 �� H2O+H+�����Դ��ǣ�NH3 �� H2O+H+=NH ![]() +H2O������NH4++H2ONH3 �� H2O+H+����3����Һ�����ԣ�����Һ��c��H+��=c��OH��������Һ�ʵ����ԣ���Һ�д��ڵ���غ�c��NH4+��+c��H+��=2c��SO
+H2O������NH4++H2ONH3 �� H2O+H+����3����Һ�����ԣ�����Һ��c��H+��=c��OH��������Һ�ʵ����ԣ���Һ�д��ڵ���غ�c��NH4+��+c��H+��=2c��SO ![]() ��+c��OH����������c��SO
��+c��OH����������c��SO ![]() ��=0.5c��NH
��=0.5c��NH ![]() ��=0.5amol/l�����Դ��ǣ�0.5amol/l����4��pH=1��������Һ��C�� H +��=0.1molL��1 �� ������Ũ���백ˮŨ����ȣ������ͬ������ǡ�÷�Ӧ�����Σ����NH4+��ˮ�⣬C�� NH
��=0.5amol/l�����Դ��ǣ�0.5amol/l����4��pH=1��������Һ��C�� H +��=0.1molL��1 �� ������Ũ���백ˮŨ����ȣ������ͬ������ǡ�÷�Ӧ�����Σ����NH4+��ˮ�⣬C�� NH ![]() ����C��SO
����C��SO ![]() ��=2��1����ˮ���ǽ����ģ�����c��NH
��=2��1����ˮ���ǽ����ģ�����c��NH ![]() ����c��SO
����c��SO ![]() ������Һ�����ԣ�����c��H+����c��OH����������Һ������Ũ�ȴ�С˳����c��NH
������Һ�����ԣ�����c��H+����c��OH����������Һ������Ũ�ȴ�С˳����c��NH ![]() ����c��SO
����c��SO ![]() ����c��H+����c��OH���������Դ��ǣ�c��NH
����c��H+����c��OH���������Դ��ǣ�c��NH ![]() ����c��SO
����c��SO ![]() ����c��H+����c��OH������
����c��H+����c��OH������
�����㾫����������Ŀ����֪�������������������ˮ��Һ�еĵ���ƽ������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ݻ�ѧ��Ӧ�����ܵ��й�֪ʶ����д���пհף�
I. ��1�����Ц�H��ʾ����ȼ���ȵ���________����ʾ��Ӧ�к��Ȧ�H����57.3 kJ��mol��1����________(���H1������H2���͡���H3����)��
A��C(s)��![]() O2(g)===CO(g) ��H1
O2(g)===CO(g) ��H1
B��2H2(g)��O2(g)===2H2O(l) ��H2
C��C(s)��O2(g)===CO2(g) ��H3
D��![]() Ba(OH)2(aq)��
Ba(OH)2(aq)��![]() H2SO4(aq)===
H2SO4(aq)===![]() BaSO4(s)��H2O(l) ��H4
BaSO4(s)��H2O(l) ��H4
E��NaOH(aq)��HCl(aq)===NaCl(aq)��H2O(l) ��H5
F��2NaOH(aq)��H2SO4(aq)===Na2SO4(aq)��2H2O(l) ��H6
(2)��ѧ��Ӧ�������仯(��H)�뷴Ӧ���������ļ����й�(���ܿ��Լ�����Ϊ�Ͽ�1 mol��ѧ��ʱ�������յ�����)���±��Dz��ֻ�ѧ���ļ������ݣ�
��ѧ�� | P��P | P��O | O=O | P=O |
����(kJ��mol��1) | a | 360 | 500 | 434 |
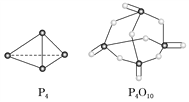
��֪����(P4)��ȼ����Ϊ2 378 kJ��mol��1��������ȫȼ�յIJ���(P4O10)�Ľṹ����ͼ��ʾ�����ϱ���a��________(����������)��
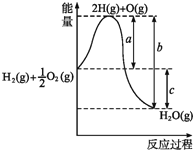
II.��֪2mol����ȼ������Һ̬ˮʱ�ų�572KJ��������Ӧ���Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��l�� ��H=-572KJ��mol-1��
��3���÷�Ӧ������������ܺ�______������ڡ���С�ڡ����ڡ�����Ӧ��������ܺ͡�
��4����2mol������ȫȼ������ˮ��������ų�������_______�������������������572KJ��
III.��5����֪16g��������ȫȼ��ʱ�ų�148.4KJ��������д����ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ��____________________________________��
��6����ͼ��ʾ��1 mol NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��
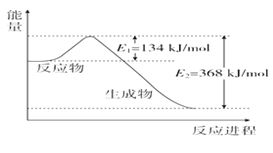
��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��_______________________________��
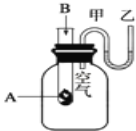
����Ŀ��ijС��ȡһ��������FeSO4���壬������ͼװ�ý���ʵ�飮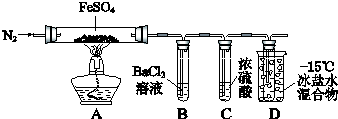
ʵ����� | ʵ������ | |
�� | ͨ��һ��ʱ��N2 �� ���� | A�й����Ϊ����ɫ��B���а�ɫ������D�Թ�������ɫҺ�� |
�� | �ô��л��ǵ�ľ������װ��D�ĵ��ܿ� | ľ����ȼ |
�� | ��ַ�Ӧ��ֹͣ���ȣ���ȴ��ȡA�й��壬������ | �����ܽ⣬��Һ�ʻ�ɫ |
�� | ����������Һ����D�Թ��� | ��Һ��Ϊdz��ɫ |
��֪��SO2 �۵㩁72�棬�е㩁10�棻SO3�۵�16.8�棬�е�44.8�森
��1��ʵ��۷�Ӧ�����ӷ���ʽ�� ��
��2���ֽ���̳�����ʹľ����ȼ�������⣬����A�й�����ɫ�仯�Ʋ⣬��һ�������壬������ ��
��3��ʵ��ܷ�Ӧ�����ӷ���ʽ�� ��
��4��ijͬѧ����B�е�������ΪFeSO4�ֽ�һ����SO3���ɣ�����Ϊ�Ƿ���ȷ��ԭ���ǣ��ñ�Ҫ�����ֺͻ�ѧ����ʽ���ͣ�