题目内容
【题目】下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
【答案】C
【解析】解:A.铅蓄电池放电时铅电极为原电池的负极,发生氧化反应,正极发生还原反应,故A错误;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠,阴极上得到氢气和氢氧化钠,故B错误;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液,则给铁钉镀铜可采用CuSO4作电镀液,故C正确;
D.生铁浸泡在食盐水中发生吸氧腐蚀,在酸性溶液中发生析氢腐蚀,故D错误.
故选C.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】请根据化学反应与热能的有关知识,填写下列空白:
I. (1)下列ΔH表示物质燃烧热的是________;表示反应中和热ΔH=-57.3 kJ·mol-1的是________(填“ΔH1”“ΔH2”和“ΔH3”等)。
A.C(s)+![]() O2(g)===CO(g) ΔH1
O2(g)===CO(g) ΔH1
B.2H2(g)+O2(g)===2H2O(l) ΔH2
C.C(s)+O2(g)===CO2(g) ΔH3
D.![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() BaSO4(s)+H2O(l) ΔH4
BaSO4(s)+H2O(l) ΔH4
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH6
(2)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1 mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | a | 360 | 500 | 434 |
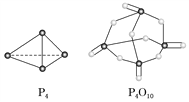
已知白磷(P4)的燃烧热为2 378 kJ·mol-1,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=________(保留到整数)。
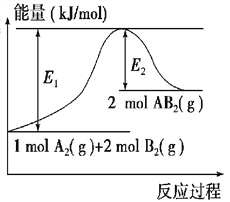
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
(6)如图所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,

请写出NO2和CO反应的热化学方程式:_______________________________。
【题目】某小组取一定质量的FeSO4固体,利用下图装置进行实验.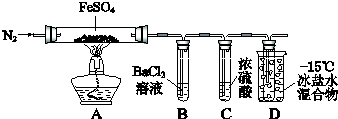
实验过程 | 实验现象 | |
① | 通入一段时间N2 , 加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2 熔点﹣72℃,沸点﹣10℃;SO3熔点16.8℃,沸点44.8℃.
(1)实验③反应的离子方程式是 .
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有气体,依据是 .
(3)实验④反应的离子方程式是 .
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成.你认为是否正确,原因是(用必要的文字和化学方程式解释)