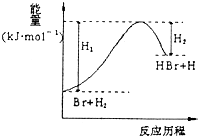
题目内容
【题目】对于反应MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O,_____元素化合价降低,_______电子,发生_______反应,被_________;氧化剂是_____________,氧化产物是_____________。
【答案】Mn 得 还原 还原 MnO2 Cl2
【解析】
根据MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O分析,MnO2中Mn的化合价从+4价变为+2价,化合价降低得电子,发生还原反应,做氧化剂,MnCl2为还原产物;HCl中,Cl从-1价变为0价,化合价升高失电子,发生氧化反应,做还原剂,Cl2为氧化产物。
答案为:Mn;得;还原;还原;MnO2;Cl2。

【题目】按照物质的树状分类和交叉分类,HNO3应属于
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸⑥强酸 ⑦一元酸 ⑧化合物 ⑨混合物
A. ①②③④⑤⑥⑦⑧B. ①④⑥⑦⑧
C. ①⑨D. ①④⑤⑥⑦
【题目】某小组取一定质量的FeSO4固体,利用下图装置进行实验.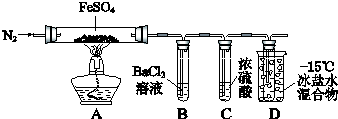
实验过程 | 实验现象 | |
① | 通入一段时间N2 , 加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2 熔点﹣72℃,沸点﹣10℃;SO3熔点16.8℃,沸点44.8℃.
(1)实验③反应的离子方程式是 .
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有气体,依据是 .
(3)实验④反应的离子方程式是 .
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成.你认为是否正确,原因是(用必要的文字和化学方程式解释)