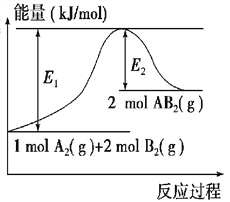
题目内容
【题目】分别与Ne、Ar核外电子排布相同的两种离子所形成的化合物可能是
A. NaFB. MgI2C. Na2SD. K2S
【答案】C
【解析】
A. NaF中,Na+、F均为与Ne的核外电子排布相同的离子,故A错误;
B. MgI2中,Mg2+为与Ne的核外电子排布相同的离子,I为与Xe的核外电子排布相同的离子,故B错误;
C. Na2S中,与Ne的核外电子排布相同的离子为Na+,与Ar的核外电子排布相同的离子为S2,二者形成化合物为Na2S,故C正确;
D. K2S中,K+、S2均为与Ar的核外电子排布相同的离子,故D错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】某小组取一定质量的FeSO4固体,利用下图装置进行实验.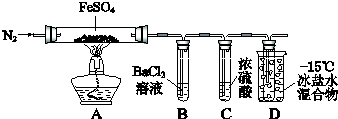
实验过程 | 实验现象 | |
① | 通入一段时间N2 , 加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2 熔点﹣72℃,沸点﹣10℃;SO3熔点16.8℃,沸点44.8℃.
(1)实验③反应的离子方程式是 .
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有气体,依据是 .
(3)实验④反应的离子方程式是 .
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成.你认为是否正确,原因是(用必要的文字和化学方程式解释)