题目内容
【题目】用如图所示实验装置探究铜丝与过量浓硫酸的反应。
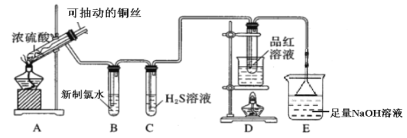
(1)写出A中发生反应的化学方程式__________。在此反应中,浓硫酸表现出来的性质有__________。(填字母序号)
A.强氧化性 B.酸性 C.吸水性 D.脱水性
(2)一段时间后,观察到B中溶液黄绿色褪去,B中反应的化学方程式为__________。C中的实验现象为__________。
(3)D中的实验现象是__________,一段时间后,点燃D处酒精灯,可以观察到__________。
(4)E装置中NaOH溶液的作用是__________。
(5)研究小组认为可以用H2O2溶液来验证E中溶液含有SO32-,进行了实验i。
实验序号 | 操作 | 现象 |
i | a. 取少量E中溶液,向其中加入适量H2O2溶液,振荡,观察。 | 无明显现象 |
b. 然后滴加__________,振荡,观察。 | 无明显现象 | |
c. 再滴加__________,振荡,观察。 | 白色沉淀 |
通过实验i可证明E中溶液含有SO32-,写出操作b、c中滴加的试剂是__________、__________。
(6)研究小组反思实验方案i不够严谨,设计了对比实验,证明了E中含有SO32-。该对比实验方案是__________。
【答案】Cu+2H2SO4(浓)![]() 2SO2↑+CuSO4+2H2O AB SO2+2H2O+Cl2=H2SO4+2HCl 产生黄色固体 品红褪色 溶液恢复原来的颜色 吸收SO2,防止污染空气 盐酸 BaCl2溶液 取E中溶液,滴加盐酸,再滴加氯化钡溶液,不产生白色沉淀/沉淀量明显小于实验i,结合实验i,证明E中有SO32-
2SO2↑+CuSO4+2H2O AB SO2+2H2O+Cl2=H2SO4+2HCl 产生黄色固体 品红褪色 溶液恢复原来的颜色 吸收SO2,防止污染空气 盐酸 BaCl2溶液 取E中溶液,滴加盐酸,再滴加氯化钡溶液,不产生白色沉淀/沉淀量明显小于实验i,结合实验i,证明E中有SO32-
【解析】
在装置图中,A中发生反应为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;B中,SO2+Cl2+2H2O=2HCl+H2SO4;C中,Cl2+H2S=S↓+2HCl;D中,SO2使品红褪色,加热后又恢复红色;E中,SO2+2NaOH==Na2SO3+H2O。
CuSO4+SO2↑+2H2O;B中,SO2+Cl2+2H2O=2HCl+H2SO4;C中,Cl2+H2S=S↓+2HCl;D中,SO2使品红褪色,加热后又恢复红色;E中,SO2+2NaOH==Na2SO3+H2O。
(1)A中,Cu与浓H2SO4发生反应,化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。在此反应中,生成SO2,表现出强氧化性,生成CuSO4,表现出酸性,故选AB。答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O。在此反应中,生成SO2,表现出强氧化性,生成CuSO4,表现出酸性,故选AB。答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;AB;
CuSO4+SO2↑+2H2O;AB;
(2)一段时间后,观察到B中溶液黄绿色褪去,表明B中Cl2与SO2在水溶液中反应,生成无色物质,反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4。C中发生反应为Cl2+H2S=S↓+2HCl,实验现象为产生黄色固体。答案为:SO2+Cl2+2H2O=2HCl+H2SO4;产生黄色固体;
(3)D中SO2与品红结合生成无色化合物,实验现象是品红褪色,一段时间后,点燃D处酒精灯,无色化合物分解,又生成原物质,可以观察到溶液恢复原来的颜色。答案为:品红褪色;溶液恢复原来的颜色;
(4)E装置中发生反应SO2+2NaOH==Na2SO3+H2O,NaOH溶液的作用是吸收SO2,防止污染空气。答案为:吸收SO2,防止污染空气;
(5)通过实验i可证明E中溶液含有SO32-,从现象可推知,c中沉淀为BaSO4,则b中加入酸,操作b、c中滴加的试剂是盐酸、BaCl2溶液。答案为:盐酸;BaCl2溶液;
(6)研究小组反思实验方案i不够严谨,因为方案i中SO42-、SO32-都转化为BaSO4沉淀,设计了对比实验,即只让SO42-生成沉淀,与方案i进行沉淀量对比,从而证明了E中含有SO32-。该对比实验方案是取E中溶液,滴加盐酸,再滴加氯化钡溶液,不产生白色沉淀/沉淀量明显小于实验i,结合实验i,证明E中有SO32-。答案为:取E中溶液,滴加盐酸,再滴加氯化钡溶液,不产生白色沉淀/沉淀量明显小于实验i,结合实验i,证明E中有SO32-。

【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
(1)NH3与CO2在120℃,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g),△H=-xkJ/mol(x>0),其他相关数据如表:
CO(NH2)2(s)+H2O(g),△H=-xkJ/mol(x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | a | b | z | d |
则表中z(用x、a、b、d表示)的大小为___。
(2)120℃时,在2L密闭反应容器中充入3molCO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应60s内CO2的平均反应速率为___。

下列能使正反应的化学反应速率加快的措施有___。
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。
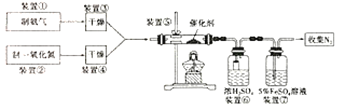


(3)写出装置⑤中反应的化学方程式___;
(4)装置①和装置②如图4,仪器A中盛放的药品名称为___。装置②中,先在试管中加入2-3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是___。
(5)装置⑥中,小段玻璃管的作用是___;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是___。