题目内容
【题目】氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含NH4+废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
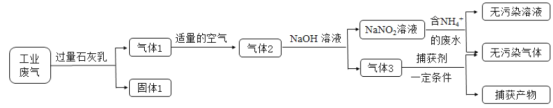
已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体1的主要成分有Ca(OH)2、__________(填化学式)。
(2)若实验室需要配制3 mol·L-1NaOH溶液1L进行模拟测试,需称取NaOH固体质量为__________g。
(3)用NaNO2溶液处理含NH4+废水反应的离子方程式为__________。
(4)验证废水中NH4+已基本除净的方法是___________(写出操作、现象与结论)。
(5)气体1转化为气体2时空气不能过量的原因是__________。
(6)捕获剂捕获的气体主要是__________(填化学式)。
(7)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2可以使淀粉变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl。需选用的物质是__________(填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤
【答案】CaCO3 、CaSO3 120 NH4++NO2-=N2↑+2H2O 取少量处理后废水于试管中,加入NaOH溶液加热,将湿润的红色石蕊试纸放在试管口,若无明显现象则可证明NH4+已基本除净 气体1转化为气体2时,其中NO:NO2物质的量之比为1:1时才可以被NaOH溶液完全转化成NaNO2,若空气过量,则与NaOH反应生成NaNO3和NaNO2的混合溶液,因此空气不能过量 CO C
【解析】
工业废气(主要含NO、CO、CO2、SO2、N2)用过量石灰乳吸收,CO2、SO2与Ca(OH)2反应生成CaCO3、CaSO3,成为固体1的主要成分,此时气体1为NO、CO、N2;通入适量空气,主要与NO作用生成NO2,成为空气2的主要成分;通入NaOH溶液中,从产物NaNO2看,前面通入的空气,只能将一部分NO氧化为NO2,否则生成的NaNO2中会混入NaNO3;NO2-与NH4+发生氧化还原反应,生成N2和H2O,气体3为CO,被捕获剂捕获。
(1)从以上分析可知,固体1的主要成分有Ca(OH)2、CaCO3、CaSO3。答案为:CaCO3、CaSO3;
(2)若实验室需要配制3 mol·L-1 NaOH溶液1L进行模拟测试,需称取NaOH固体质量为3 mol·L-1 ×1L×40g/mol=120 g。答案为:120;
(3)用NaNO2溶液处理含NH4+废水时,NO2-与NH4+反应生成N2和H2O,反应的离子方程式为NH4++NO2-=N2↑+2H2O。答案为:NH4++NO2-=N2↑+2H2O;
(4)验证废水中NH4+已基本除净,可加碱检测气体的性质,方法是取少量处理后废水于试管中,加入NaOH溶液加热,将湿润的红色石蕊试纸放在试管口,若无明显现象则可证明NH4+已基本除净。答案为:取少量处理后废水于试管中,加入NaOH溶液加热,将湿润的红色石蕊试纸放在试管口,若无明显现象则可证明NH4+已基本除净;
(5)由以上分析知,气体1转化为气体2时空气不能过量的原因是气体1转化为气体2时,其中n(NO):n(NO2)物质的量之比为1:1时才可以被NaOH溶液完全转化成NaNO2,若空气过量,则与NaOH反应生成NaNO3和NaNO2的混合溶液,因此空气不能过量。答案为:气体1转化为气体2时,其中n(NO):n(NO2)物质的量之比为1:1时才可以被NaOH溶液完全转化成NaNO2,若空气过量,则与NaOH反应生成NaNO3和NaNO2的混合溶液,因此空气不能过量;
(6)由以上分析可知,捕获剂捕获的气体主要是CO。答案为:CO;
(7)鉴别NaNO2和NaCl,需利用反应2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,所以需加I-、淀粉、酸,从而确定选用的物质是①②⑤,故选C。答案为:C。

 阅读快车系列答案
阅读快车系列答案