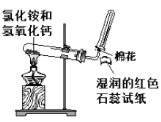
题目内容
【题目】下列反应对应的离子方程式正确的是
A.向Al2(SO4)3溶液中加入过量氨水:Al3++4OH-=![]() +2H2O
+2H2O
B.将Cl2通入FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.将钠投入硫酸铜溶液中:2Na+Cu2+ =Cu+ 2Na+
D.向小苏打溶液中加入少量Ca(OH)2 溶液:Ca2++2OH-+![]() =CaCO3↓+2H2O+
=CaCO3↓+2H2O+ ![]()
【答案】D
【解析】
A.Al2(SO4)3和氨水反应生成氢氧化铝和水,A错误;
B.电荷不守恒,正确的为2Fe2++Cl2=2Fe3++2Cl-,B错误;
C.钠太活泼,投入硫酸铜溶液中,先与水反应生成氢氧化钠和氢气,不会置换Cu,C错误;
D.Ca(OH)2少量,则Ca(OH)2一定反应完,设Ca(OH)2的物质的量为1mol,则有1molCa2+、2molOH-参加反应,2molOH-消耗2molHCO3-,所以该反应的离子方程式为Ca2++2OH-+![]() =CaCO3↓+2H2O+
=CaCO3↓+2H2O+ ![]() ,D正确。
,D正确。
答案选D。

【题目】用如图所示实验装置探究铜丝与过量浓硫酸的反应。
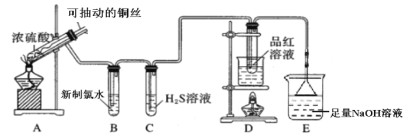
(1)写出A中发生反应的化学方程式__________。在此反应中,浓硫酸表现出来的性质有__________。(填字母序号)
A.强氧化性 B.酸性 C.吸水性 D.脱水性
(2)一段时间后,观察到B中溶液黄绿色褪去,B中反应的化学方程式为__________。C中的实验现象为__________。
(3)D中的实验现象是__________,一段时间后,点燃D处酒精灯,可以观察到__________。
(4)E装置中NaOH溶液的作用是__________。
(5)研究小组认为可以用H2O2溶液来验证E中溶液含有SO32-,进行了实验i。
实验序号 | 操作 | 现象 |
i | a. 取少量E中溶液,向其中加入适量H2O2溶液,振荡,观察。 | 无明显现象 |
b. 然后滴加__________,振荡,观察。 | 无明显现象 | |
c. 再滴加__________,振荡,观察。 | 白色沉淀 |
通过实验i可证明E中溶液含有SO32-,写出操作b、c中滴加的试剂是__________、__________。
(6)研究小组反思实验方案i不够严谨,设计了对比实验,证明了E中含有SO32-。该对比实验方案是__________。