题目内容
【题目】叠氮化钠(NaN3)是白色六方系晶体,剧毒,易溶于水,是HN3(氢叠氮酸,酸性与醋酸相似的弱酸)的钠盐。回答下列问题:
(1)实验室可用NaN3分解(生成两种单质)制备高纯N2,已知NA为阿伏加德罗常数的值,每生成1 mol N2转移电子数为___________。
(2)NaN3和稀硫酸反应制HN3的离子方程式为______________。
(3)NaNH2与N2O在210~220℃时反应可制备NaN3,同时放出能使湿润红色石蕊试纸变蓝的气体,该反应的化学方程式为_____________________。
(4)测定工业品叠氮化钠中NaN3质量分数的实验步骤如下:
(I)准确称量试样m g,另加少许NaOH于烧杯中,加入适量蒸馏水溶解,转移至250mL容量瓶中定容;
(II)准确移取配得的溶液20.00mL于锥形瓶中,慢慢加入V1 mL c1 mol·L-1(NH4)2Ce(NO3)6溶液,充分反应后,加适量水稀释,加入5 mL浓硫酸,加2滴邻罗啉指示剂,用c2 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定到溶液由淡绿色变为黄红色(Ce4++Fe2+=Ce3++Fe3+),消耗标准溶液V2 mL。
①NaN3与(NH4)2Ce(NO3)6溶液反应的氧化产物为N2,还原产物为Ce(NO3)3,其离子方程式为______。
②则样品中NaN3的质量分数为__________(列出计算表达式)。
【答案】![]() N3-+H+=HN3 2NaNH2+N2O=NaN3+ NaOH+NH3 2N3-+2Ce4+
N3-+H+=HN3 2NaNH2+N2O=NaN3+ NaOH+NH3 2N3-+2Ce4+![]() 3N2↑+2Ce3+
3N2↑+2Ce3+ 
【解析】
(1) 2NaN3=2Na+3N2,由反应式可得出关系式3N2——2e-,从而可计算出生成1 mol N2转移的电子数。
(2)书写NaN3和稀硫酸反应制HN3的离子方程式时,NaN3能拆成离子形式,因为它是一种可溶性盐。
(3)从氧化还原分析,NaNH2+N2O=NaN3+H2O,但产物中还有NH3生成,则还需再加入NaNH2,认为它跟H2O反应,从而生成NaOH和NH3,把两个反应合二为一,即可得出该反应的化学方程式。
(4) ①在整个过程中,发生以下反应:
2N3-+2Ce4+=3N2+2Ce3+,Ce4++Fe2+=Ce3++Fe3+。
②通过第二个离子方程式,可求出过量的Ce4+的物质的量,利用总量与过量的Ce4+的差值,求出与N3-反应的Ce4+的物质的量,从而求出N3-的物质的量,最后求出样品中NaN3的质量分数。
(1) 2NaN3=2Na+3N2,由反应式可得出关系式3N2——2e-,现在N2为1 mol,则转移的电子数![]() 。答案为:
。答案为:![]() ;
;
(2)NaN3和稀硫酸反应制HN3的离子方程式为N3-+H+=HN3。答案为:N3-+H+=HN3;
(3)从氧化还原分析,NaNH2+N2O=NaN3+H2O,但产物中还有NH3生成,则另一反应为NaNH2+H2O=NaOH+NH3,从而得出该反应的化学方程式2NaNH2+N2O=NaN3+ NaOH+NH3。答案为:2NaNH2+N2O=NaN3+ NaOH+NH3;
(4) ①在整个过程中,发生以下反应:
2N3-+2Ce4+![]() 3N2↑+2Ce3+,Ce4++Fe2+=Ce3++Fe3+。
3N2↑+2Ce3+,Ce4++Fe2+=Ce3++Fe3+。
①NaN3与(NH4)2Ce(NO3)6溶液反应的氧化产物为N2,还原产物为Ce(NO3)3,其离子方程式为2N3-+2Ce4+![]() 3N2↑+2Ce3+;答案为:2N3-+2Ce4+
3N2↑+2Ce3+;答案为:2N3-+2Ce4+![]() 3N2↑+2Ce3+;
3N2↑+2Ce3+;
②20.00mL溶液中,N3-的物质的量为:(c1V1-c2V2)×10-3mol,
样品中NaN3的质量分数为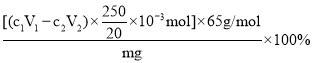
=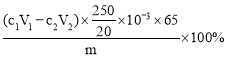 。答案为:
。答案为: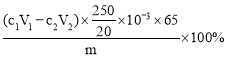 。
。