题目内容
【题目】用废易拉罐制备明矾的实验步骤如下:
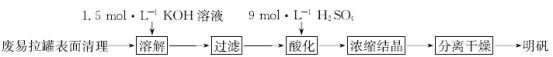
回答下列问题:
(1)清除已剪成片状的废易拉罐表面颜料及塑料内膜的方法是_________________。
(2)实验需用100 mL 1.5 mol·L-1 KOH溶液,配制时需称取KOH固体质量为_________;配制过程中需要的玻璃仪器有烧杯、量筒、玻璃棒及_____________和_____________。
(3)“溶解”时发生反应的化学方程式为________________。
(4)“酸化”时,为使硫酸滴加量不过量太多,正确的操作依据是_________。
(5)鉴定明矾中含有K+的操作方法及现象是_________。
【答案】可用砂纸打磨或灼烧 8.4g 100mL容量瓶 胶头滴管 2Al+2NaOH+2H2O=2NaA1O2+3H2↑ 滴加硫酸先生成白色沉淀,继续滴加硫酸至生成的沉淀刚好完全溶解为止 用玻璃棒蘸明矾溶液少许,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,说明含有K+
【解析】
(1)废易拉罐表面颜料及塑料内膜可用砂纸将其强行处理,也可利用塑料的可燃性处理;
(2)配制100 mL 1.5 mol·L-1 KOH溶液时,需称取KOH固体质量为1.5 mol·L-1 ×0.1L×56g/mol;配制过程中需要的玻璃仪器有烧杯、量筒、玻璃棒及100mL容量瓶和胶头滴管;
(3)“溶解”时发生的反应是铝与氢氧化钠溶液的反应;
(4)“酸化”时,为使硫酸滴加量不过量太多,可以起初生成的沉淀刚好完全溶解为判断依据;
(5)鉴定明矾中含有K+的操作方法及现象是焰色反应、透过蓝色钴玻璃观察火焰,看是否呈紫色。
(1) 清除已剪成片状的废易拉罐表面颜料及塑料内膜的方法是可用砂纸打磨或灼烧。答案为:可用砂纸打磨或灼烧;
(2)配制100 mL 1.5 mol·L-1 KOH溶液时,需称取KOH固体质量为1.5 mol·L-1 ×0.1L
×56g/mol=8.4g;配制过程中还需使用100mL容量瓶和胶头滴管。答案为:8.4g;100mL容量瓶;胶头滴管;
(3)“溶解”时发生的反应是2Al+2NaOH+2H2O=2NaA1O2+3H2↑。答案为:2Al+2NaOH+2H2O=2NaA1O2+3H2↑;
(4)“酸化”时,为使硫酸滴加量不过量太多,正确的操作依据是滴加硫酸先生成白色沉淀,继续滴加硫酸至生成的沉淀刚好完全溶解为止。答案为:滴加硫酸先生成白色沉淀,继续滴加硫酸至生成的沉淀刚好完全溶解为止;
(5)鉴定明矾中含有K+的操作方法及现象是用玻璃棒蘸明矾溶液少许,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,说明含有K+。答案为:用玻璃棒蘸明矾溶液少许,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,说明含有K+。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案