题目内容
20.下列有关化学用语的表示不正确的是( )| A. | NaClO的电子式: | |
| B. | 16O的原子结构示意图: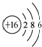 | |
| C. | 质子数为53,中子数为72的碘原子:53125I | |
| D. | 间羟基苯甲醛的结构简式: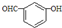 |
分析 A、NaClO是离子化合物;
B、16O的核外有8个电子;
C、原子的质量数A=质子数Z+中子数N;
D、根据间羟基苯甲醛的名称可知羟基和醛基在苯环上的位置关系.
解答 解:A、NaClO是离子化合物,Na+和ClO-间为离子键,在Cl和O之间为共价键,故电子式为: ,故A正确;
,故A正确;
B、16O的原子核内有8个质子,核外有8个电子,故原子结构示意图为: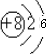 ,故B错误;
,故B错误;
C、原子的质量数A=质子数Z+中子数N,故质子数为53,中子数为72的碘原子的质量数为125,故此碘原子为53125I,故C正确;
D、根据间羟基苯甲醛的名称可知羟基和醛基在苯环上的位置为间位的关系,故结构简式为: ,故D正确.
,故D正确.
故选B.
点评 本题考查化学用语,涉及原子的表示方法、电子式、结构示意图等,注意规范应用化学用语,选项A为解答的易错点,题目难度不大.

练习册系列答案
相关题目
13.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 |
11.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | H、D、T三种氢的核素在周期表中的位置不同 | |
| B. | 元素简单气态氢化物越稳定,则非金属性越强 | |
| C. | 核外电子层结构相同的离子,核电荷数越大其离子半径也越大 | |
| D. | ⅠA与ⅦA元素形成的化合物都是离子化合物 |
8. 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
(査阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关)
I.电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体,该电极的电极反应式为:Fe2++2e-=Fe
Ⅱ.电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉一KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,巧液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示)
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3%
猜想②:Fe2+在阳极直接放电生成Fe3+
猜想③:…
(3)设计实验验证猜想①
供选择的试剂:1mol/LFeS04溶液、lmoi/L 盐酸、2mol/L 盐酸、lmol/LNaCl 溶液、2moJ/L NaCl溶液、淀粉一KI溶液、KSCN溶液,蒸馏水
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(査阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关)
I.电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体,该电极的电极反应式为:Fe2++2e-=Fe
Ⅱ.电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉一KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,巧液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示)
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3%
猜想②:Fe2+在阳极直接放电生成Fe3+
猜想③:…
(3)设计实验验证猜想①
供选择的试剂:1mol/LFeS04溶液、lmoi/L 盐酸、2mol/L 盐酸、lmol/LNaCl 溶液、2moJ/L NaCl溶液、淀粉一KI溶液、KSCN溶液,蒸馏水
| 操作 | 现象和结论 |
| ①取-定量2mol/L NaCl溶液,调 节溶液pH为4.91:再以相间装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液,滴入淀粉KI溶液 | |
15.下列说法正确的是( )
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
5.下列结构简式所代表的有机物有( )种.

| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
12.某课外实验小组设计的下列实验合理的是( )
| A. |  比较非金属性强弱Cl>C>Si | B. |  制备少量氨气 | ||
| C. |  实验室制氯气 | D. |  实验室制二氧化碳 |