题目内容
14.下列有关叙述正确的是( )| A. | 等体积、等pH的盐酸和醋酸与足量的NaOH溶液反应,消耗NaOH的物质的量相同 | |
| B. | 常温下,某物质的水溶液的pH<7,则该物质一定是酸或强酸弱碱盐 | |
| C. | 常温下,pH=12的氨水与pH=2的盐酸等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
分析 A、pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸;
B、溶液PH小于7的溶液有酸、强酸弱碱盐以及强酸的酸式盐等;
C、pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性;
D、Kw是温度的函数,温度不变Kw不变.
解答 解:A、pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸消耗NaOH的物质的量比盐酸多,故A错误;
B、某些强酸的酸式盐如NaHSO4溶液的pH<7,所以某物质的水溶液pH<7,则该物质不一定是酸或强酸弱碱盐,故B错误;
C、pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以得c(NH4+)>c(Cl-),溶液中一水合氨电离程度较小,所以c(Cl-)>c(OH-),则溶液中离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C正确;
D、温度不变,则Kw不变,故D错误;
故选C.
点评 本题考查了弱电解质的电离、酸碱混合溶液定性判断等知识点,根据酸碱混合溶液的酸碱性结合电荷守恒来分析解答,侧重于盐类水解的考查,注意把握盐类水解的规律和溶液酸碱性的判断,为解答该题的关键,题目难度中等.

练习册系列答案
相关题目
4.化学与生产生活密切相关,下列说法不正确的是( )
| A. | 小苏打可用作糕点的膨化剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | PX(对二甲苯)是生成塑料、聚酯纤维和薄膜的主要原料 | |
| D. | PM2.5指数是雾霾天气监测中的重要指标 |
5.下列结构简式所代表的有机物有( )种.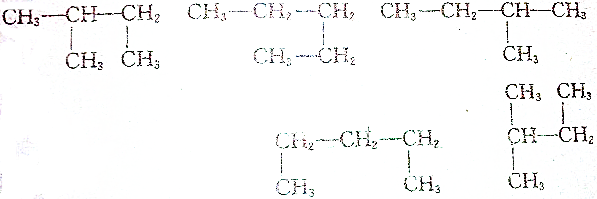
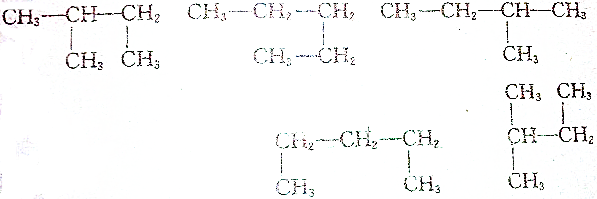
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
19.下列实验装置设计正确、且能达到目的是( )
| 编号 | A | B | C | D |
| 实验 方案 | 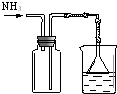 | 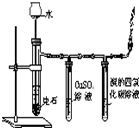 | 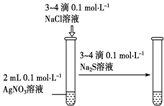 | 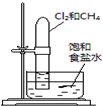 置于光亮处 |
| 实验 目的 | 收集氨气及并进行 尾气吸收 | 制取乙炔并验证炔烃 的性质 | 验证AgCl沉淀可转化为 溶解度更小的Ag2S沉淀 | 验证甲烷与氯气发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
6.下表列出了短周期内除稀有气体外的四种元素W、X、Y、Z的有关信息.请回答下列问题:
(1)写出下列元素的元素符号:XO,ZS.
(2)X、Z的最简单氢化物是由共价(填“离子”或“共价”)键形成的物质,其中稳定性较弱的氢化物的化学式为H2S.
(3)化合物YXW是由离子键和共价键构成的离子化合物(填“离子”或“共价”)
(4)由W、X、Y、Z四种元素组成的常见化合物的化学式为NaHSO4、NaHSO3,写出这两种物质发生反应的离子方程式:H++HSO3-=SO2↑+H2O.
| 原子序数 | 元素 | 有关信息 |
 | W | 质子数与Y的最外层电子数相等 |
| X | 最低化合价为-2 | |
| Y | 四种元素种仅有的金属元素 | |
| Z | 与Y的原子序数之和为W、X原子序数之和的3倍 |
(2)X、Z的最简单氢化物是由共价(填“离子”或“共价”)键形成的物质,其中稳定性较弱的氢化物的化学式为H2S.
(3)化合物YXW是由离子键和共价键构成的离子化合物(填“离子”或“共价”)
(4)由W、X、Y、Z四种元素组成的常见化合物的化学式为NaHSO4、NaHSO3,写出这两种物质发生反应的离子方程式:H++HSO3-=SO2↑+H2O.
3.化学与生活密切相关,下列说法不正确的是( )
| A. | 硅太阳能电池板在工作时,可以将化学能转化为电能 | |
| B. | 用纯碱溶液可洗涤餐具上的油污 | |
| C. | 用灼烧并闻气味的方法可区别真丝织物和人造棉 | |
| D. | 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物 |
4.下列离子中半径最大的是( )
| A. | Na+ | B. | Mg2+ | C. | O2- | D. | F- |