题目内容
【题目】在8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O反应中
(1)在上述化学方程式中用双线桥标明电子转移的方向和数目________。
(2)___发生了氧化反应,____是氧化剂。(填元素符号或化学式)
(3)上述反应中,还原剂和氧化剂的物质的量之比是___________;若生成1mol气体,则转移的电子数是_____________。
【答案】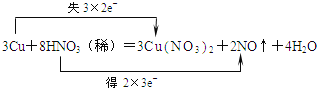 Cu HNO3 3:2 3NA或1.806×1024
Cu HNO3 3:2 3NA或1.806×1024
【解析】
8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O,中Cu的化合价从0升高到+2,是还原剂,被氧化;HNO3中N的化合价从+5降低到+2,是氧化剂,被还原,得到还原产物NO。
(1)Cu元素的化合价由0升高为+3价,N元素的化合价由+5降低为+2价,该反应中转移6e-,则双线桥标明电子转移的方向和数目为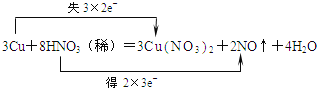 ;
;
(2)Cu的化合价从0升高到+2,是还原剂,被氧化;HNO3中N的化合价从+5降低到+2,是氧化剂,被还原,得到还原产物NO;则Cu发生了氧化反应,HNO3是氧化剂;
(3)3molCu的化合价均升高,还原剂的物质的量为3mol;由反应及N原子守恒可知,8mol酸中2mol作氧化剂、6mol作酸,则起氧化剂(被还原)作用的HNO3的物质的量为2mol,因此还原剂和氧化剂的物质的量之比3:2;HNO3中N的化合价从+5降低到+2,每生成1molNO,转移3mol电子,则电子的数目为3NA或1.806×1024。

练习册系列答案
相关题目