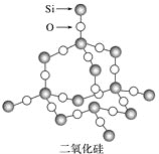
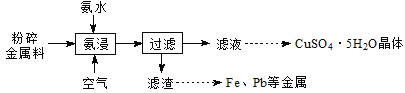
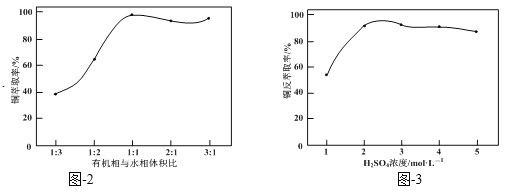
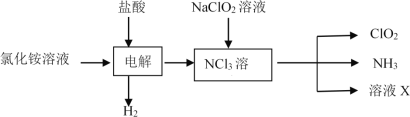
��Ŀ����
����Ŀ��ij�¶ȣ���2molCO��5 mol H2�Ļ����������ݻ�Ϊ2L���ܱ������У��ڴ����������·�����Ӧ��CO(g)��2H2(g)![]() CH3OH(g)������5min��Ӧ�ﵽƽ�⣬��ʱת�Ƶ���6mol��
CH3OH(g)������5min��Ӧ�ﵽƽ�⣬��ʱת�Ƶ���6mol��
��1��0��5min�ڣ�v(CH3OH)��____
��2��������������䣬�ٳ���2molCO��1.5molCH3OH����ʱv(��)__v(��)(����������������������)��ƽ�ⳣ��Ϊ____��
��3������������������������£�������2molCO��5molH2���ﵽ��ƽ��ʱ��H2�����������ԭƽ��Աȣ�____��
��4����֪CO��H2��һ��������Ҳ�ܺϳ��Ҵ���0.5mol�Ҵ�Һ��ȼ�����ɶ�����̼��ˮ�������ų�������Ϊ617.1kJ/mol����֪H2O��l���TH2O��g������H=+44.2kJ/mol����д���Ҵ�ȼ���ȵ��Ȼ�ѧ����ʽ____��
���𰸡�0.15mol��L��1��min��1 > 3 ��С C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l�� ��H=��1366.8kJ/mol
��������
(1)ij�¶ȣ���2molCO��5molH2�Ļ����������ݻ�Ϊ2L���ܱ������У�����5min��Ӧ�ﵽƽ�⣬���ݻ�ѧ����ʽ��֪ת�Ƶ���4mol����CO���ʵ���Ϊ1mol�����ʱת�Ƶ���6mol������CO���ʵ���=![]() ��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ���㣻
��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ���㣻
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ��(mol) 2 5 0
�仯��(mol) 1.5 3 1.5
ƽ����(mol) 0.5 2 1.5
ƽ��Ũ��c(CO)=![]() =0.25mol/L��c(H2)=
=0.25mol/L��c(H2)=![]() =1mol/L��c(CH3OH)=
=1mol/L��c(CH3OH)=![]() 0.75mol/L����ϼ״���ʾ�ķ�Ӧ����v(CH3OH)=
0.75mol/L����ϼ״���ʾ�ķ�Ӧ����v(CH3OH)=![]() ��
��
(2)ƽ�ⳣ��K=![]() �����Ũ����Qc��K�Ĺ�ϵ�ж�ƽ���ƶ��ķ����ɴ��ƶ�v(��)��v(��)�Ĺ�ϵ��
�����Ũ����Qc��K�Ĺ�ϵ�ж�ƽ���ƶ��ķ����ɴ��ƶ�v(��)��v(��)�Ĺ�ϵ��
(3)�������������������£�������2molCO��5molH2���൱������ѹǿ��ƽ��������У�
(4)�����1molҺ̬�Ҵ���ȫȼ�����ɶ�����̼��Һ̬ˮ�ų��������ٸ�����д�Ȼ�ѧ����ʽ�ķ�����д��
(1)ij�¶ȣ���2molCO��5molH2�Ļ����������ݻ�Ϊ2L���ܱ������У�����5min��Ӧ�ﵽƽ�⣬���ݻ�ѧ����ʽ��֪ת�Ƶ���4mol����CO���ʵ���Ϊ1mol�����ʱת�Ƶ���6mol������CO���ʵ���=![]() ��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ���㣻
��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ���㣻
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ��(mol) 2 5 0
�仯��(mol) 1.5 3 1.5
ƽ����(mol) 0.5 2 1.5
ƽ��Ũ��c(CO)=![]() =0.25mol/L��c(H2)=
=0.25mol/L��c(H2)=![]() =1mol/L��c(CH3OH)=
=1mol/L��c(CH3OH)=![]() 0.75mol/L����ϼ״���ʾ�ķ�Ӧ����v(CH3OH)=
0.75mol/L����ϼ״���ʾ�ķ�Ӧ����v(CH3OH)=![]() =
=![]() =0.15mol��L��1��min��1��
=0.15mol��L��1��min��1��
(2)ƽ�ⳣ��K=![]() =
=![]() =3��������������䣬�ٳ���2molCO��1.5molCH3OH�������ʱŨ����Qc=
=3��������������䣬�ٳ���2molCO��1.5molCH3OH�������ʱŨ����Qc=![]() =
= =1.2��3��˵��ƽ��������У���ʱv(��) ��v(��)��
=1.2��3��˵��ƽ��������У���ʱv(��) ��v(��)��
(3)�������������������£�������2molCO��5molH2���൱������ѹǿ��CO(g)+2H2(g)![]() CH3OH(g)����Ӧ�����������С�ķ�Ӧ��ƽ��������У��ﵽ��ƽ��ʱ��H2�����������ԭƽ��Աȼ�С��
CH3OH(g)����Ӧ�����������С�ķ�Ӧ��ƽ��������У��ﵽ��ƽ��ʱ��H2�����������ԭƽ��Աȼ�С��
(4)1molҺ̬�Ҵ���ȫȼ�����ɶ�����̼����̬ˮ�ų�����Ϊ617.1kJ��![]() =1234.2kJ��1molҺ̬�Ҵ���ȫȼ������3molˮ��3mol��̬ˮת��ΪҺ̬ˮ�ų�������44.2kJ��3=132.6kJ������1molҺ̬�Ҵ���ȫȼ�����ɶ�����̼��Һ̬ˮ�ų�����Ϊ1234.2kJ+132.6kJ=1366.8kJkJ�����Ҵ�ȼ��������̬ˮ���Ȼ�ѧ����ʽΪC2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)��H=-1366.8kJ/mol��
=1234.2kJ��1molҺ̬�Ҵ���ȫȼ������3molˮ��3mol��̬ˮת��ΪҺ̬ˮ�ų�������44.2kJ��3=132.6kJ������1molҺ̬�Ҵ���ȫȼ�����ɶ�����̼��Һ̬ˮ�ų�����Ϊ1234.2kJ+132.6kJ=1366.8kJkJ�����Ҵ�ȼ��������̬ˮ���Ȼ�ѧ����ʽΪC2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)��H=-1366.8kJ/mol��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�