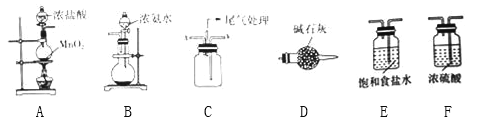
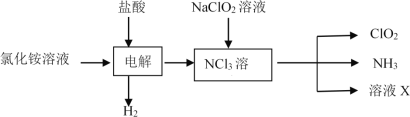
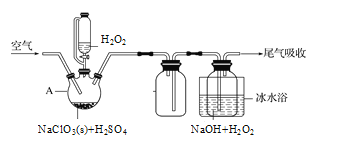
题目内容
【题目】已知在25 ℃、101 kPa 下,11.4 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出 551.76 kJ 能量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-551.76 kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) ΔH=-551.76 kJ·mol-1
B.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
C.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=5517.6 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=5517.6 kJ·mol-1
D.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-551.76 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-551.76 kJ·mol-1
【答案】B
【解析】
在25 ℃、101kPa 下,11.4g辛烷燃烧生成二氧化碳和液态水时放出551.76 kJ能量,则1mol辛烷即114g辛烷燃烧生成二氧化碳和液态水放出的热量为5517.6kJ,所以其热化学反应方程式为:C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1,答案选B。
O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1,答案选B。

练习册系列答案
相关题目
【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)