题目内容
X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| | 原子或分子相关信息 | 单质及其化合物相关信息 |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的1/2 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为 ,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 。
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积可能 种情况(填一或二)。
(1)第四周期 VIII族 4Fe(OH)2+O2+2H2O="=" 4Fe(OH)3
(2) 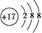 6H++Al2O3=2Al3++3H2O
6H++Al2O3=2Al3++3H2O
(3)光导纤维 SiO2+2C高温Si+2CO↑ Ge+2 H2O2+2NaOH=Na2GeO3+3H2O
(4)二
解析试题分析:X、Y、Z、W四种常见元素分别为Cl、Al、Si、Fe。(1)氢氧化亚铁易被氧气氧化为氢氧化铁;(3)二氧化硅最重要的用途就是生产光导纤维,工业上是用碳还原二氧化硅制备粗硅,再净化得到纯硅;(4)给出的溶液中含有铝元素0.05mol,生成的沉淀为0.02mol,故有两种情况,一种是加入的氢氧化钠刚好生成沉淀,另一种是铝离子全生成沉淀后,再加入氢氧化钠,沉淀部分溶解。
考点:考查物质结构有关问题。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
| 元素 | 相关信息 |
| W | W的基态原子L层电子数是K层电子数的3倍 |
| X | X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
| Y | 单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
| Z | Z的基态原子外围电子排布式为(n-1)d10ns1 |
(1)Y位于元素周期表第________周期第________族;X的基态原子核外电子排布式是 。
(2)W的简单离子半径 X的简单离子半径(填“>”、“<”或“=”);Y的第一电离能比Z的 (填“大”或“小”);W、X的最简单气态氢化物中,沸点较高的是 (填化学式)。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,该反应的化学方程式为 。
(4)W元素形成的多种化合物分子中,含有极性共价键和非极性共价键的分子名称为
(任写一种)。
(5)在25℃、101 kPa下,已知Z固体单质在Y2气体中完全燃烧后恢复至原状态,平均每转移1mol 电子放热110.05kJ,该反应的热化学方程式是 。
A、B、C、D、E、 F是周期表中短周期的六种元素,有关性质或结构信息如下表:
| 元素 | 有关性质或结构信息 |
| A | 雷雨天大气中会有A的一种单质生成 |
| B | B离子与A离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D是制造黑火药的一种成分,也可用于杀菌消毒 |
| E | E与D同周期,且在该周期中原子半径最小Ks5u |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
(1)A与C以原子个数比为1:1形成的化合物的电子式为 ,将0.6 mol该化合物投入到100 mL 3 mol/L BE3溶液中的离子方程式为 , 。
(2)F的氢化物是由 (极性或非极性)键形成的 (极性或非极性)分子,写出实验室制备该氢化物的化学方程式 。
(3)下图可用于实验证明D、E的非金属性的强弱。
① 溶液a和b分别为 , (写化学式)。
②溶液a与固体a反应的离子方程式为 。
③非金属性D E(填大于或小于),请从原子结构的角度解释原因 。