题目内容
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)ZYQ的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,请你仅用一个化学方程式表示甲既有氧化性又有还原性:________________________________。
(1)第二周期第VA族(2分);2(2分);C、O(2分) (2)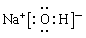 (2分)
(2分)
(3)H2O>NH3(2分) (4)abd (2分) (5)2H2O2 2H2O + O2↑(2分)
2H2O + O2↑(2分)
解析试题分析:Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),则Q的原子半径最小,Z的原子半径最大,所以Q是H元素,Z是Na元素;R、X、Y三种元素的原子核外电子层数相同,这三种元素处于第二周期,同一周期中R的一种单质的熔点最高,金刚石的熔点最高,所以R是C元素,Y与Q、R、X、Z均能形成多种常见化合物,则Y是O元素,所以X是N元素。
(1)X是N元素,其处于第二周期第VA族,其核外电子排布式为1s22s22p3,所以有两种电子云。根据核外电子排布可知,在这五种元素中,最外层有两个未成对电子的元素是C和O元素。
(2)ZYQ是氢氧化钠,氢氧化钠是离子化合物,其电子式是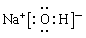 。
。
(3)Q分别与X、Y形成的最简单化合物是NH3、H2O,非金属的非金属性越强,其氢化物的稳定性越强,O的非金属性大于N元素,所以稳定性H2O>NH3。
(4)Q与R两元素组成的分子可能是甲烷、乙烯、乙炔、苯等烃类物质,其中甲烷为正四面体结构,乙烯和苯为平面结构,乙炔为直线形结构,故答案选abd。
(5)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,所以甲应该是双氧水。双氧水不稳定,易分解生成氧气和水,反应的化学方程式为2H2O2 2H2O + O2↑。
2H2O + O2↑。
考点:考查元素周期表的结构、元素周期律的应用、核外电子排布以及分子的空间构型等

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| | 原子或分子相关信息 | 单质及其化合物相关信息 |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的1/2 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为 ,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 。
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积可能 种情况(填一或二)。
A、B、C、D、E五种短周期元素,原子序数依次增大,有关信息如下。
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质既可与盐酸反应,又可与NaOH溶液反应 |
| E | 原子最外层电子数比次外层电子数少1个 |
请回答下列问题:
(1)A的氢化物的水溶液能使酚酞试液变红,原因是(用电离方程式表示),实验室制取该氢化物的化学方程式是 。
(2)A与B可组成质量比为7∶16的三原子分子,下列环境问题与该物质的排放有关的是(填序号)。
①酸雨 ②温室效应 ③臭氧层破坏 ④光化学污染
(3)C的最高价氧化物的水化物与E单质反应可用于生产消毒液,其离子方程式是 。
(4)D在元素周期表中的位置是。由元素A、D组成某化合物,具有良好电绝缘性,该物质与水缓慢反应的化学方程式是 。
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______;W元素基态原子电子排布式
为______________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________________。
A.常温下Z的单质和T的单质状态不同
B. T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D. T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为______,它所形成的晶体类型为______; Y的常见氢化物易液化的主要原因是________________________。
(4)元素X与钙元素可以形成一种离子化合物,该化合物的阴离子和CO互为等电子体,该化合物的电子式为 ;其中元素X的杂化类型是 。
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X有多种同素异形体,写出X2电子式是 ,
(2)X、Y、Z三种元素电负性由大到小顺序为_____。
(3)W元素原子基态时原子的电子排布式_________________。
(4)Z位于元素周期表第 周期第 族
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH (填“=”、“>”或“<”),理由是: (用离子方程式表示)。
(6).25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。


 Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2