题目内容
(18分)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是 。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6] 2+等。写出一种与配体CO互为等电子体的阴离子 。配体NH3中N原子的杂化类型为 , 它可用作致冷剂的原因是 。若[Ni(NH3)6] 2+为正八面体构型,则[Ni(CO)2(NH3)4] 2+的结构有 种。
(3)镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为 ,NiO(OH)溶于浓盐酸的化学方程式为 。
(4)镍和镧(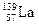 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
LaNixHy+y NiO(OH)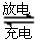 LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式
LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式

(1)Ni在元素周期表中的位置是 。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6] 2+等。写出一种与配体CO互为等电子体的阴离子 。配体NH3中N原子的杂化类型为 , 它可用作致冷剂的原因是 。若[Ni(NH3)6] 2+为正八面体构型,则[Ni(CO)2(NH3)4] 2+的结构有 种。
(3)镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为 ,NiO(OH)溶于浓盐酸的化学方程式为 。
(4)镍和镧(
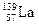 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:LaNixHy+y NiO(OH)
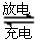 LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式
LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式 
(1)第四周期,第Ⅷ族 (2)CN— C22- sp3 液态氨汽化时需吸收大量的热 2
(3)[Ar]3d7;或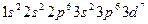 2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O
2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O
(4)x="5 " LaNi5H6+6OH- -6e-==LaNi5+6H2O (每空2分
(3)[Ar]3d7;或
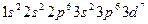 2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O
2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O(4)x="5 " LaNi5H6+6OH- -6e-==LaNi5+6H2O (每空2分
略

练习册系列答案
相关题目
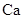 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)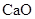 。
。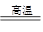 Ca3(PO4)2 + Fe;
Ca3(PO4)2 + Fe;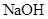 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测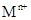 的方法是 (用离子方程式表达);
的方法是 (用离子方程式表达);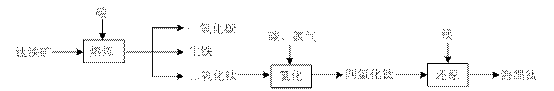
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量