题目内容
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):
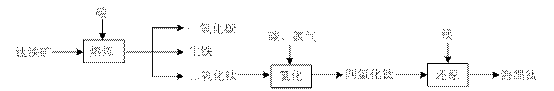
上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量 白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
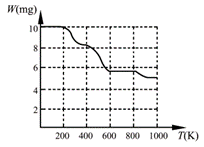
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
⑴ 熵变大于零(△S>0) 隔绝空气
⑵ 10 TiO2++2H2O=TiO(OH)2↓+2H+
⑶ d
⑵ 10 TiO2++2H2O=TiO(OH)2↓+2H+
⑶ d
本题通过钛及其化合物的制备与应用为背景素材,考查学生运用化学理论知识解决工业实际问题的能力以及对图表、图示的观察、分析、运用和数据处理能力。
⑴化学反应的发生至少必须满足“焓变小于零、熵变大于零”中的一个;反应控制在隔绝空气(或在惰性环境中进行)的条件下进行,是考虑到金属镁与空气中氧气、氮气、二氧化碳的反应(钛的性质、四氯化钛的水解等知识学生不熟悉)。⑵第一问主要考查Ksp与pH的简单计算,第二问由于TiO(OH)2的Ksp最小,故最容易水解。⑶依据M[BaTiO (C2O4)2·4H2O]:M(BaTiO3)=10.00:5.19,可知白色固体A的化学式为BaTiO (C2O4)2·4H2O。
⑴化学反应的发生至少必须满足“焓变小于零、熵变大于零”中的一个;反应控制在隔绝空气(或在惰性环境中进行)的条件下进行,是考虑到金属镁与空气中氧气、氮气、二氧化碳的反应(钛的性质、四氯化钛的水解等知识学生不熟悉)。⑵第一问主要考查Ksp与pH的简单计算,第二问由于TiO(OH)2的Ksp最小,故最容易水解。⑶依据M[BaTiO (C2O4)2·4H2O]:M(BaTiO3)=10.00:5.19,可知白色固体A的化学式为BaTiO (C2O4)2·4H2O。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
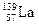 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为: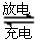 LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式
LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式 
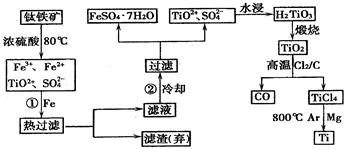
 2MgCl2+Ti , 在Ar气体中进行的目的是
2MgCl2+Ti , 在Ar气体中进行的目的是