题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
试回答下列问题:
(1)写出元素e的基态原子电子排布式________________,其未成对电子数为________。
(2)c在空气中燃烧产物的分子构型为_____,中心原子的杂化形式为______杂化。c能形成一种八元环状形同王冠的单质分子,原子的杂化形式为______杂化。
(3)b单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
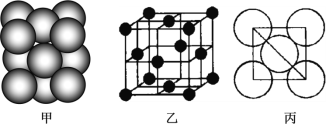
若已知b的原子半径为d厘米,NA代表阿伏加德罗常数,b的相对原子质量为M,请回答:
①晶胞中b原子的配位数为_____,表示原子空间占有率的代数式为_____________。
②该晶体的密度为_____________g/cm3(用含有关字母的代数式表示)。a、f中,与单质b晶体中原子的堆积方式相同的是__________(填元素符号)。
【答案】 [Ar]3d54s1 或1s22s22p63s23p63d54s1 6 V形 sp2 sp3 12 ![]()
![]() Cu
Cu
【解析】本题考查的原子电子排布和杂化类型以及晶胞的计算等,难度中等,关键为晶胞的计算。
(1) 结合元素周期表分析,a为镁,b为铝,c为硫,e为铬,f为铜。元素e为铬,是24号元素,其基态电子排布式为 [Ar]3d54s1 或1s22s22p63s23p63d54s1;其中3d和4s能级上的电子都未成对,所以未成对的电子有6个; (2)硫燃烧从二氧化硫,分子构型为V形 ;中心原子硫σ键电子对数为2,价层电子对数=(6-2×2)/2+1=3,硫采用sp2 杂化;硫能形成一种八元环状形同王冠的单质分子,每个硫原子形成2个硫硫键,且含有2对孤对电子对,则采用sp3杂化; (3). ①由晶胞结构图可知,以顶点原子为研究对象,与之最近的原子处于面心上,,每个顶点原子为12面共用,所以晶胞中该原子的配位数为12;②晶胞中铝原子数目为![]() ,晶胞质量为4M/NA,铝原子半径为d厘米,则晶胞棱长为
,晶胞质量为4M/NA,铝原子半径为d厘米,则晶胞棱长为![]() cm,每个晶胞中含有4个原子,则铝原子总体积为
cm,每个晶胞中含有4个原子,则铝原子总体积为![]() ,晶胞体积为
,晶胞体积为![]() ,故空间利用率为
,故空间利用率为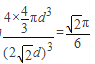 ,故晶胞的密度为
,故晶胞的密度为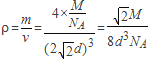 ;镁、锌、钛属于六方最密堆积型,而铝属于面心立方最密堆积型,所以与铝单质晶体中原子的堆积方式相同的是铜。
;镁、锌、钛属于六方最密堆积型,而铝属于面心立方最密堆积型,所以与铝单质晶体中原子的堆积方式相同的是铜。