��Ŀ����
����Ŀ������������һ�ֹ�ҵ�Σ���������������Ӧ�ù㷺��������ͼ��ʾװ�ã��г�װ����ʡ�ԣ���ҩƷ��̽���������������ᷴӦ���������ɷ֡�
��֪����NO��NO2��2OH����2NO2����H2O������Һ�����¶ȣ�NO2 21�桢 NO �C152��
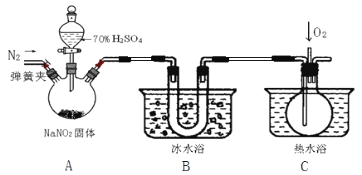
��1����ӦǰӦ���ɼУ���ͨ��һ��ʱ�䵪�����ų�װ���еĿ�����Ŀ����__________��
��2����ʵ��װ������ȱ���� ________________________________________________��
��3���ڹرյ��ɼУ���Һ©������������70%�����A�в�������ɫ���塣
��ȷ��A�в��������庬��NO�����ݵ�������____________________________��
��װ��B��������_______________________________________________________��
��4��ͨ������ʵ��̽�����̣��ɵó�װ��A�з�Ӧ�Ļ�ѧ����ʽ��_______________��
��5����ˮ����(N2H4��H2O)��һ����Ҫ�Ļ���ԭ�ϣ���ҽҩ��ũҵ��ȼ���϶����Ź㷺��Ӧ�á�Ŀǰ���ҹ�����ˮ���¾��������ط���������NaClO��Һ��NaOH��Һ������[CO(NH2)2]��Ӧ�Ƶô��£�N2H4�������ɴ��·�Ӧ�Ļ�ѧ����ʽΪ_______________��
�ڻ������ʱ�����£�N2H4��Ϊȼ�ϣ��������������������������������ʣ�д����Ӧ����ʽ _______��
���𰸡���ֹ�������ɵ�NO����ȫ������NO2�������A�з�Ӧ���������鲻��ȫ��β������װ��C����������ɫ��������ʹNO2��ȫҺ��2NaNO2+H2SO4=Na2SO4+NO2��+NO��+H2ONaClO+CO��NH2��2+2NaOH=N2H4��H2O+Na2CO3+NaCl2N2H4 +2NO2=3N2+4H2O
��������
��1�������е�����������NO�����Ա������ž���������ֹ�������ɵ�NO����ȫ������NO2����ɶ�A�з�Ӧ���������鲻��ȫ��
��2����ʵ��װ������ȱ������β������װ�ã��ᵼ�µ���������ֱ���ŷŵ������������Ⱦ��
��3���������NO����װ��B����ȴ����C�е����壬�ܺ�������Ӧ�����ɺ���ɫ���壬��������C�г��ֺ���ɫ��������װ��B������������ʹNO2��ȫҺ����
��4��װ��A���������������ᷴӦ���������ơ�����������һ��������ˮ����Ӧ�Ļ�ѧ����ʽ��2NaNO2+H2SO4=Na2SO4+NO2��+NO��+H2O��
��5����NaClO��Һ��NaOH��Һ������[CO(NH2)2]��Ӧ�Ƶô�����N2H4����ͬʱ����̼���ƺ��Ȼ��ƣ������ɴ��·�Ӧ�Ļ�ѧ����ʽΪNaClO+CO��NH2��2+2NaOH=N2H4��H2O+Na2CO3+NaCl��
�ڻ������ʱ��������N2H4��Ϊȼ�ϣ��������������������������������ʵ�����ˮ����Ӧ�ķ���ʽΪ2N2H4 +2NO2=3N2+4H2O��

����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
�Իش��������⣺
��1��д��Ԫ��e�Ļ�̬ԭ�ӵ����Ų�ʽ________________����δ�ɶԵ�����Ϊ________��
��2��c�ڿ�����ȼ�ղ���ķ��ӹ���Ϊ_____������ԭ�ӵ��ӻ���ʽΪ______�ӻ���c���γ�һ�ְ�Ԫ��״��ͬ���ڵĵ��ʷ��ӣ�ԭ�ӵ��ӻ���ʽΪ______�ӻ���
��3��b���ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ��

����֪b��ԭ�Ӱ뾶Ϊd���ף�NA���������ӵ�������b�����ԭ������ΪM����ش�
�پ�����bԭ�ӵ���λ��Ϊ_____����ʾԭ�ӿռ�ռ���ʵĴ���ʽΪ_____________��
�ڸþ�����ܶ�Ϊ_____________g/cm3���ú��й���ĸ�Ĵ���ʽ��ʾ����a��f�У��뵥��b������ԭ�ӵĶѻ���ʽ��ͬ����__________����Ԫ�ط��ţ���