题目内容
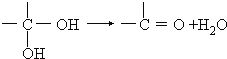
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
【答案】 0.0125mol·L-1·min-1 ac 大于 不变 
【解析】本题考查了化学反应速率的定量表示方法和化学平衡常数、化学平衡的影响因素等知识点,同一化学反应中化学平衡常数只与温度有关,与反应物、生成物的浓度无关。
(1)4分钟内氨气的反应速率为0.10/4=0.025 mol·L-1·min-1,根据化学计量数关系计算氮气的速率为 0.0125mol·L-1·min-1; (2)该反应是可逆反应,所以反应物不能完全转化我生成物,所以氨气的浓度不可能为0.20 mol·L-1,反应放热,升高温度,平衡向逆向移动,降低温度,平衡向正向移动,所以氨气的浓度不可能为0.10 mol·L-1,故选ac;(3) 达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,平衡向逆向移动,新平衡时NH3的浓度恰好为原来的2倍,则由于物质的量增加,所以容器的体积大于二分之一倍的原体积,但是由于没有改变温度,所以平衡常数不变; (4) 在第5分钟末将容器的体积缩小一半,则浓度变为原来的2倍,平衡正向移动,氨气的浓度逐渐增大,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),则NH3浓度的变化曲线如图: 。
。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
试回答下列问题:
(1)写出元素e的基态原子电子排布式________________,其未成对电子数为________。
(2)c在空气中燃烧产物的分子构型为_____,中心原子的杂化形式为______杂化。c能形成一种八元环状形同王冠的单质分子,原子的杂化形式为______杂化。
(3)b单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
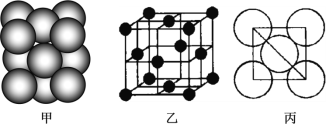
若已知b的原子半径为d厘米,NA代表阿伏加德罗常数,b的相对原子质量为M,请回答:
①晶胞中b原子的配位数为_____,表示原子空间占有率的代数式为_____________。
②该晶体的密度为_____________g/cm3(用含有关字母的代数式表示)。a、f中,与单质b晶体中原子的堆积方式相同的是__________(填元素符号)。
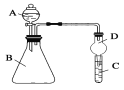
【题目】(题文)某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究。
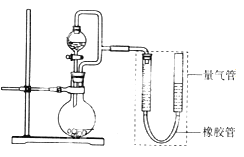
(实验一)探究影响化学反应速率的因素。
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
检查该装置气密性的方法是_______________________________________________。
比较实验I和Ⅱ可以得出的结论是____________________________________________。
(实验二)探究铁的电化学腐蚀。
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面_________右侧液面_________(选填“上升”、“下降”)。
②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,发现左、右侧液面变化较_______(选填“快”、“慢”,下同),说明原电池反应比一般化学反应_______。
③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:___________________________________,正极的电极反应是___________________________。