��Ŀ����
����Ŀ����.��ͼ������ͬѧ��Ƶ�һ������ԭ���װ�ã���ش��������⡣

(1)�� a�缫����Ϊ̼��b��ҺΪ FeCl3��Һ���������ĵ缫��ӦʽΪ____������1.6g���������ܽ�ʱ��ת�Ƶĵ���Ϊ____mol��
(2)�� a �缫����Ϊ����b��ҺΪŨ���ᣬ��������ָ��Ҳ��ƫת������ӵ�����Ϊ______�� __________����缫���ϣ���ͬ������Һ�е�NO3-��________���ƶ���
(3)����ȼ�ϵ�������ں���ɻ������ֵ����30%KOH��ҺΪ�������Һ������ʱ�ܷ�ӦΪ��2H2+O2=2H2O���������ĵ缫����ʽΪ________________��
����֪H-H ����N-H ����N��N ���ļ��ֱܷ�Ϊ 436kJ/mol��391kJ/mol��946 kJ/mol�����ڹ�ҵ�ϳɰ��ķ�Ӧ������ݼ��ܵ������ж��������⣺
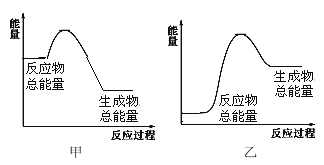
(4)���� 1 mol NH3���� ����________(���������������ų���������________kJ���÷�Ӧ�������仯����ͼ__________��ʾ����������������������
���𰸡�Fe3++e-=Fe2+ 0.05 ͭ(Cu) ��(Fe) ͭ(Cu) 2H2O+O2+4e-=4OH- �ų� 46 ��
��������
(1)��a�缫����Ϊ̼��b��ҺΪ FeCl3��Һ��CuΪ������CΪ�����������Ϸ�����ԭ��Ӧ������CuΪ+2�۽�����ÿ1molCu��Ӧ��ת��2mol���Ӽ��㣻
(2)��a�缫����Ϊ������һ���缫ΪCu������Fe��Ũ����ᷢ���ۻ���������b��ҺΪŨ���ᣬFeΪ������CuΪ�����������ɸ����������������������ƶ����������������ƶ���
(3)����ȼ�ϵ���ڼ��Ե������Һ�У�������O2��õ��ӱ�ΪOH-��
(4)��Ӧ��Ϊ�ϼ�����������ɼ��ų������IJ�ֵ�����������仯�жϷ�Ӧ�ȣ�����Ϸ��ȷ�Ӧ��Ӧ���������������������ߣ����ȷ�Ӧ��Ӧ�����������������������жϡ�
(1)��a�缫����Ϊ̼��b��ҺΪ FeCl3��Һ�������ڵ缫���Cu>C��CuΪ������CΪ�����������Ϸ�����ԭ��Ӧ����Һ�е�Fe3+��õ��ӣ��缫��ӦʽΪFe3++e-=Fe2+������CuΪ+2�۽�����ÿ1molCu��Ӧ��ת��2mol���Ӽ��㣬n(Cu)=1.6g��64g/mol=0.025mol�����Ե���ת�Ƶ����ʵ���Ϊn(e-)=2n(Cu)=0.05mol��
(2)��a�缫����Ϊ������һ���缫ΪCu��b��ҺΪŨ���ᣬ����Fe��Ũ����ᷢ���ۻ���������FeΪ������CuΪ�����������ɸ���Cu��������Fe������ͬ�ֵ����ų⣬���ֵ�������������������NO3-������ɽ϶ฺ��Cu�缫�ƶ���������������Fe�缫�ƶ���
(3)����ȼ�ϵ���ڼ��Ե������Һ�У�������O2��õ��ӱ�ΪOH-���缫��ӦʽΪ2H2O+O2+4e-=4OH-��
(4)����H-H ����N-H ����N��N ���ļ��ֱܷ�Ϊ 436kJ/mol��391kJ/mol��946 kJ/mol��N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ��H=946kJ/mol��
NH3(g) ��H=946kJ/mol��![]() +436kJ/mol��
+436kJ/mol��![]() -391kJ/mol��3=-46 kJ/mol��˵������ 1 mol NH3���� ���ɷų�����46kJ����ӦΪ���ȷ�Ӧ��˵����Ӧ���������������������ߣ���˸÷�Ӧ�������仯����ͼ�ױ�ʾ��
-391kJ/mol��3=-46 kJ/mol��˵������ 1 mol NH3���� ���ɷų�����46kJ����ӦΪ���ȷ�Ӧ��˵����Ӧ���������������������ߣ���˸÷�Ӧ�������仯����ͼ�ױ�ʾ��

����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
�Իش��������⣺
��1��д��Ԫ��e�Ļ�̬ԭ�ӵ����Ų�ʽ________________����δ�ɶԵ�����Ϊ________��
��2��c�ڿ�����ȼ�ղ���ķ��ӹ���Ϊ_____������ԭ�ӵ��ӻ���ʽΪ______�ӻ���c���γ�һ�ְ�Ԫ��״��ͬ���ڵĵ��ʷ��ӣ�ԭ�ӵ��ӻ���ʽΪ______�ӻ���
��3��b���ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ��
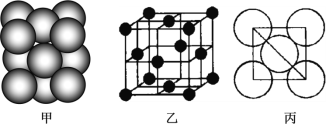
����֪b��ԭ�Ӱ뾶Ϊd���ף�NA���������ӵ�������b�����ԭ������ΪM����ش�
�پ�����bԭ�ӵ���λ��Ϊ_____����ʾԭ�ӿռ�ռ���ʵĴ���ʽΪ_____________��
�ڸþ�����ܶ�Ϊ_____________g/cm3���ú��й���ĸ�Ĵ���ʽ��ʾ����a��f�У��뵥��b������ԭ�ӵĶѻ���ʽ��ͬ����__________����Ԫ�ط��ţ���