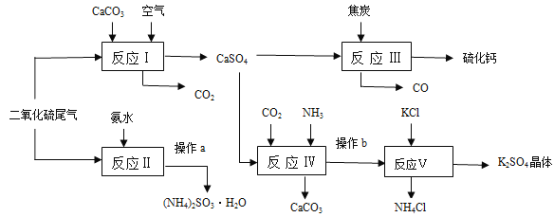
题目内容
【题目】请按要求回答下列问题:
(1)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如右图所示。
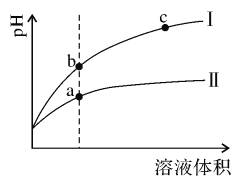
①稀释醋酸时pH值变化曲线是:___________(填:“I”或“Ⅱ”),
②b点溶液的导电性比c点溶液的导电性:___________(填:“强”、“弱”或“无法比较”),
③a、c两点Kw的数值相比,a___________c(填:“大于”、“小于”或“等于”),
(2)NH4Al(SO4)2在食品、医药、电子工业中用途广泛。
①NH4Al(SO4)2可做净水剂,其理由是:___________(用离子方程式表示)。
②相同条件下,0.1mol/L NH4Al(SO4)2溶液中,c(NH4+)___________0.1mol/L NH4HSO4溶液中c(NH4+)(填“大于”、等于”或“小于”)。
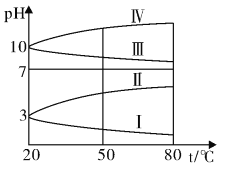
③下图是0.1mo/LNH4Al(SO)2溶液的pH随温度变化的图像,其中符合0.1mo/LNH4Al(SO4)2溶液的曲线是____ (填字母)。导致溶液pH随温度变化的原因是:_________________________________。
【答案】II 强 等于 Al3++3H2O![]() Al(OH)3(胶体)+3H+ 小于 I 升温使NH4Al(SO4)2水解平衡向正反应方向移动,酸性增强,pH降低
Al(OH)3(胶体)+3H+ 小于 I 升温使NH4Al(SO4)2水解平衡向正反应方向移动,酸性增强,pH降低
【解析】
(1)①根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度;
②利用c点、b点溶液中的离子浓度来分析导电性;
③K w 只与温度有关,与溶液的种类以及浓度大小没有关系;
(2)①Al3+水解生成的Al(OH)3胶体具有吸附性;
②NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
③NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大。
(1)①根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线;
②溶液导电性取决于离子浓度,b点的H + 浓度大,导电性强;
③Kw只与温度有关,与溶液的种类以及浓度大小没有关系,所以a、c两点Kw的数值相等;
故答案为:II;强;等于;
(2)①Al3+水解生成的Al(OH)3胶体具有吸附性,离子方程式为Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体能吸附悬浮颗粒使其沉降从而净化水,
Al(OH)3(胶体)+3H+,Al(OH)3胶体能吸附悬浮颗粒使其沉降从而净化水,
故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
②NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,则浓度相同的NH4Al(SO4)2溶液和NH4HSO4溶液中,NH4+浓度较大的是NH4HSO4溶液,故NH4Al(SO4)2溶液中c(NH4+)小于NH4HSO4溶液,
故答案为:小于;
③NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:Ⅰ;升温使NH4Al(SO4)2水解平衡向正反应方向移动,酸性增强,pH降低。