题目内容
【题目】回答下列问题:
(1) 同温同压下,同体积的NH3和H2S气体的质量比是________________;同质量的NH3和H2S气体的体积比是_____________,同质量的NH3和H2S气体中所含氢原子个数比是_____________,若两者所含氢原子个数相等,它们的物质的量比是__________;
(2)在100ml Al2(SO4)3溶液中含0.6molSO42-,从中取出1/4 体积的该溶液再稀释到100 ml,则稀释后的溶液中SO42-的物质的量浓度为_______________。。
(3)在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4∶3时,则Mg2+与SO42-物质的量浓度之比为_____________;
【答案】1:2 2:1 3:1 2:3 1.5 mol·L-1 8:5
【解析】
(1)同温同压下,同体积的气体物质的量相同,气体的质量之比等于相对分子质量之比;
根据质量计算物质的量,气体的体积之比等于物质的量之比;根据物质的量和分子的组成判断氢原子数目之比;根据分子组成计算氢原子数相等时物质的量关系,进而计算物质的量之比。
(2)根据c=![]() 计算稀释后的溶液中SO42-的物质的量浓度;
计算稀释后的溶液中SO42-的物质的量浓度;
(3)Mg2+与Cl-的物质的量浓度之比为4∶3,则可以分别设出氯化镁和硫酸镁的物质的量,然后判断即可。
(1)根据阿伏加德罗定律定律,相同条件下,相同体积的任何气体都含有相同的数目的粒子,
则同温同压下,同体积的气体物质的量相同,根据m=nM可以知道,
气体的质量之比等于相对分子质量之比,所以同温同压下,同体积的氨气和硫化氢气体的质量比为17:34=1:2;
设氨和硫化氢气体的质量分别为34g,则n(NH3)=![]() =2mol,n(H2S)=
=2mol,n(H2S)=![]() =1mol,
=1mol,
相同条件下,气体体积之比等于其物质的量之比,则同质量的氨和硫化氢气体的体积比为2:1;
2molNH3中H原子的个数为:2mol×3×NA/mol=6 NA,1mol H2S中H原子的个数为:1mol×2×NA/mol=2 NA,其中含有的氢的原子个数比为:6:2=3:1;
若二者氢原子数相等,设含有6molH原子,则氨气的物质的量为2mol,硫化氢的物质的量为3mol,则物质的量之比为2:3。
因此,本题正确答案是:1:2 ;2:1 ;3:1 ;2:3。
(2)含0.6molSO42-的Al2(SO4)3的溶液,从中取出![]() 体积的该溶液再稀释到100mL,SO42-的物质的量为0.6mol×
体积的该溶液再稀释到100mL,SO42-的物质的量为0.6mol×![]() =0.15mol,则稀释后的溶液中SO42-的物质的量浓度为
=0.15mol,则稀释后的溶液中SO42-的物质的量浓度为![]() =1.5mol/L,
=1.5mol/L,
因此,本题正确答案是:1.5mol·L-1;
(3)设氯化镁的物质的量为x,硫酸镁的物质的量为y,根据题意有![]() =
=![]() ,计算得出
,计算得出![]() =
=![]() ,所以镁离子的物质的量为x+y=
,所以镁离子的物质的量为x+y=![]() ,硫酸根的物质的量=y=
,硫酸根的物质的量=y=![]() ,两者的比值为8:5,
,两者的比值为8:5,
因此,本题正确答案是:8:5。

【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
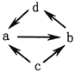
【题目】下列各组物质之间通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| Na2O | Na2O2 | Na | NaOH |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Si | SiO2 | Na2SiO3 | H2SiO3 |
A. ①② B. ②③ C. ②④ D. ①③