题目内容
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

【答案】 碘酸钾 加热 KCl KH(IO3)2+KOH![]() 2KIO3+H2O或(HIO3+KOH
2KIO3+H2O或(HIO3+KOH![]() KIO3+H2O) 2H2O+2e-
KIO3+H2O) 2H2O+2e-![]() 2OH-+H2↑ K+ a到b 产生Cl2易污染环境等
2OH-+H2↑ K+ a到b 产生Cl2易污染环境等
【解析】分析:本题考查的是化学工业以及电化学的相关知识。应该从题目的化工流程入手,判断每步流程操作的目的,就可以顺利解决问题。
详解:(1)根据氯酸钾(KClO3)可以推测KIO3为碘酸钾。
(2)将溶解在溶液中的气体排出的一般方法是将溶液加热,原因是气体的溶解度是随温度上升而下减小。第一步反应得到的产品中氯气在“逐Cl2”时除去,根据图示,碘酸钾在最后得到,所以过滤时KH(IO3)2应该在滤渣中,所以滤液中主要为KCl。“调pH”的主要目的是将KH(IO3)2转化为KIO3,所以方程式为:KH(IO3)2+KOH=2KIO3+H2O。
(3)①由图示,阴极为氢氧化钾溶液,所以反应为水电离的氢离子得电子,反应为2H2O + 2e- = 2OH- + H2↑。
②电解时,溶液中的阳离子应该向阴极迁移,明显是溶液中大量存在的钾离子迁移,方向为由左向右,即由a到b。
③KClO3氧化法的最大不足之处在于,生产中会产生污染环境的氯气。

【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
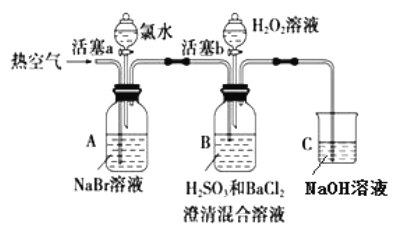
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。