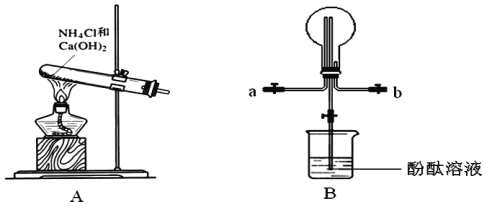
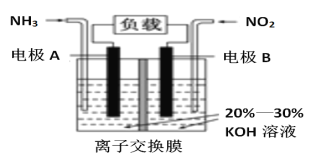
题目内容
【题目】硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。请根据下图中的合成路线回答下列问题:
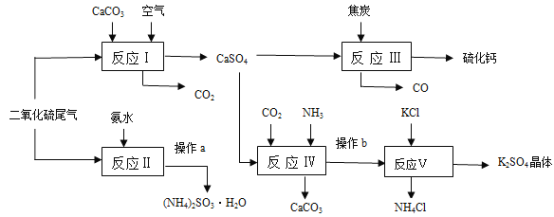
(1)生产中,常向反应II的溶液中加入强还原性的对苯二酚等物质,目的是__________。
(2)操作a中,必须的操作步骤有_______________、___________、过滤等。
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________。
(4)写出反应Ⅳ的化学方程式__________________________________________________;操作b所得滤液中阳离子的检验方法是________________。
(5)该生产过程中可以循环使用的物质是_______________。
(6)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________________________。
(7)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏[M(CaSO4·2H2O)=172],且反应过程中96%的二氧化硫转化为石膏,则可生产石膏______ t。
【答案】防止亚硫酸铵被氧化 蒸发浓缩 冷却结晶 1:4 CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3 取少量滤液于试管中,加入足量NaOH溶液并加热,生成有刺激性气味的气体且能使湿润的红色石蕊试纸变蓝,则滤液中含NH4+ CaCO3,CO2 4(NH4)2SO3+2NO2=4(NH4)2SO4+N2 38.7
【解析】
由流程可知,I中发生2CaCO3+O2+2SO2=2CaSO4+2CO2,反应II为二氧化硫与氨水反应生成亚硫酸铵,即SO2+2NH3H2O=(NH4)2SO3+H2O,Ⅲ中发生CaSO4+4C=CaS+4CO↑,反应Ⅳ为NH4HCO3、CaSO4、NH3反应生成碳酸钙和硫酸铵,发生NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4,可知CaCO3、CO2可循环使用,反应Ⅴ为硫酸铵溶液中加入氯化钾生成硫酸钾晶体,所以操作b为过滤,滤液中含有的阳离子为铵根离子,然后据此分析。
(1)反应II为二氧化硫与氨水反应生成亚硫酸铵,即SO2+2NH3H2O=(NH4)2SO3+H2O生产中,常向反应II的溶液中加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵被氧化;
(2)操作a是从亚硫酸铵溶液中获得亚硫酸铵晶体,使亚硫酸铵析出晶体的方法是:蒸发浓缩,冷却结晶,过滤;
(3)Ⅲ中发生CaSO4+4C=CaS+4CO↑,氧化剂是硫酸钙,还原剂是碳,氧化剂与还原剂的物质的量之比为1:4;
(4)反应Ⅳ为NH4HCO3、CaSO4、NH3反应生成碳酸钙和硫酸铵,反应方程式为CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓,操作b所得滤液中阳离子为铵根离子,其操作为取溶液少许加入NaOH并加热,生成有刺激性气味的气体能使湿润的红色石蕊试纸变蓝;
(5)根据分析可知,该生产过程中可以循环使用的物质是CaCO3,CO2;
(6)(NH4)2SO3可以和二氧化氮反应生成氮气和硫酸铵,化学反应方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
(7)二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,反应方程式为:SO2+CaCO3=CaSO3+CO2,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO42H2O,反应方程式为:2CaSO3+O2+4H2O=2CaSO42H2O,总反应为:2CaCO3+2SO2+O2+4H2O═2CaSO42H2O+2CO2;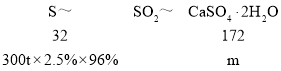
![]() ,解得m=38.7t。
,解得m=38.7t。

【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表
元素 | 元素特征信息 |
A | 其单质是密度最小的物质。 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一。 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物。 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)写出下列元素的名称:C___________,E______________
(2)写出A、B、C形成的化合物的电子式____________________
(3)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)____________________
(4)写出E单质与A、B、C形成的化合物反应的化学方程式:__________________________