题目内容
5.某有机物甲经氧化后得到乙(C2H3O2Cl),而甲经水解可得到丙.1mol丙和2mol乙反应可得到一种含氯的酯(C6H8O4Cl2).以此推断甲的结构简式为( )| A. |  | B. |  | C. |  | D. | HO-CH2-CH2OH |
分析 甲经氧化后得乙(分子式为C2H3O2Cl),乙应为CH2ClCOOH,说明甲中含有能被氧化的官能团,可能为-OH或-CHO,甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2),说明丙中含有两个-OH,应为CH2OHCH2OH,则甲为CH2ClCH2OH.
解答 解:乙应为CH2ClCOOH,甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2),说明甲水解后生成
CH2OHCH2OH,则甲为CH2ClCH2OH.
故选A.
点评 本题考查有机物的推断,题目难度中等,本题注意根据乙的分子式确定乙的结构简式,根据丙和乙反应产物确定甲的组成和结构.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
15.关于电解法精炼铜的下列说法正确的是( )
| A. | 电解结束后,在阳极底部会有阳极泥产生,主要成分是铁、金和银 | |
| B. | 电解结束后,溶液中Cu2+浓度变大 | |
| C. | 纯铜作阳极,粗铜作阴极,硫酸铜为电解质溶液 | |
| D. | 粗铜作阳极,纯铜作阴极,硫酸铜为电解质溶液 |
16.230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
| A. | Th元素的质量数是232 | B. | 230Th和232Th的化学性质相同 | ||
| C. | 232Th转化成233U是化学变化 | D. | Th元素的相对原子质量是231 |
13.玻璃器皿上沾有一些用水洗不掉的残留物,其洗涤方法正确的是( )
①用酒精洗涤试管内壁上残留的碘②用酒精洗涤试剂瓶中残留的苯酚③用稀氨水洗涤试管壁上银镜④用热碱液洗涤试管内壁上的油脂.
①用酒精洗涤试管内壁上残留的碘②用酒精洗涤试剂瓶中残留的苯酚③用稀氨水洗涤试管壁上银镜④用热碱液洗涤试管内壁上的油脂.
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
20.某一反应物的浓度是1.0mol/L,经过10s后,它的浓度变成了0.2mol/L,在这10s内,它的反应速率为( )
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
10.下列物质中,在常温常压时呈气态的是( )
| A. | 乙醇 | B. | 苯 | C. | 甲醛 | D. | 四氯化碳 |
4.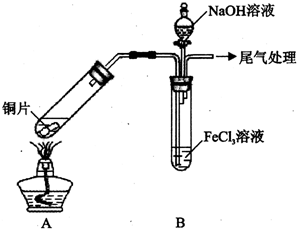 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO${\;}_{4}^{2-}$.Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
向步骤①和步骤②所得溶液中加入某种试剂,溶液立即出现蓝色沉淀,则该试剂中含有溶质的化学式是K3[Fe(CN)6].
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO${\;}_{4}^{2-}$.Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
| 步骤② | 往5mL 1mol•LFeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热在较短时间内溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.短时间内发现溶液颜色变成浅绿色. |
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
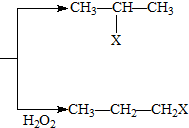 (X为卤素原子)
(X为卤素原子)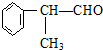 的物质,该物质是一种香料.
的物质,该物质是一种香料.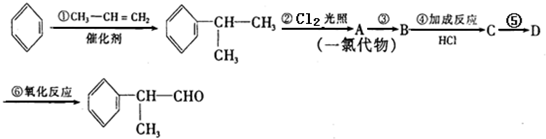
 .
.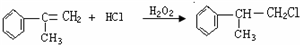 .
.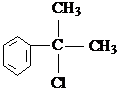 的水解产物
的水解产物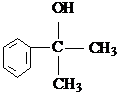 不能经氧化反应⑥而得到产品.
不能经氧化反应⑥而得到产品.
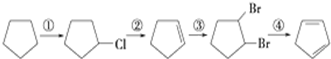
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.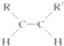 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式:
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式: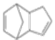 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$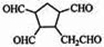 .
. ).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):
).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):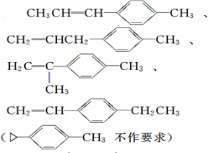 .
.