题目内容
14.在有机物:①CH3CH3和C2H6;②CH2=CH2和CH3CH=CH2;③CH3CH2C≡CH和CH3C≡CCH3;④O2和O3;⑤126126C和136136C中互为同系物的是②;(填编号,下同)
互为同分异构体的是③;
互为同素异形体的是④;
互为同位素的是⑤.
分析 ①CH3CH3和C2H6分别为乙烷的结构简式和分子式,是一种物质;
②CH2=CH2和CH3CH=CH2,结构相似,分子组成上相差1个CH2原子团,属于同系物;
③CH3CH2C≡CH和CH3C≡CCH3分子式相同,官能团的位置不同,属于同分异构体;
④O2和O3均属于氧元素的不同种单质,互为同素异形体;
⑤126126C和136136C均是碳元素的不同种原子,互为同位素,据此解答即可.
解答 解:②中乙烯(CH2=CH2)和丙烯(CH3CH=CH2),结构相似,分子组成上相差1个CH2原子团,属于同系物;
③CH3CH2C≡CH和CH3C≡CCH3分子式相同,官能团的位置不同,属于同分异构体;
④O2和O3均属于氧元素的不同种单质,互为同素异形体;
⑤126126C和136136C均是碳元素的不同种原子,互为同位素,故答案为:②;③;④;⑤.
点评 本题主要考查的是同系物、同分异构体、同位素的概念,属于常考题类型之一,注意概念间的区别,难度不大.

练习册系列答案
相关题目
4.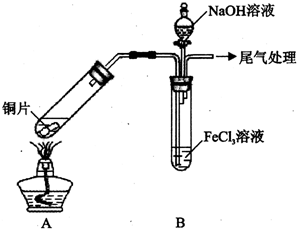 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO2−42−4.Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
向步骤①和步骤②所得溶液中加入某种试剂,溶液立即出现蓝色沉淀,则该试剂中含有溶质的化学式是K3[Fe(CN)6].
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO2−42−4.Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
| 步骤② | 往5mL 1mol•LFeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热在较短时间内溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.短时间内发现溶液颜色变成浅绿色. |
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
5.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5 NA | |
| B. | 14g乙烯和丙烯的混合物中总原子数为3 NA | |
| C. | 标准状况下,22.4 L氯仿中含有的氯原子数目为3 NA | |
| D. | 17.6 g丙烷中所含的极性共价键为4 NA |
2.以下化学用语正确的是( )
| A. | 一CH3(甲基)的电子式为 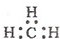 | B. | 硝基苯的结构简式: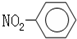 | ||
| C. | 甲醛的结构式: | D. | 乙醇的分子式:CH3CH2OH |
6.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S
②氢化物的稳定性:HF>HCl>H2S
③还原性:S2->Cl->Br-
④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S.
①微粒半径:S2->Cl>S
②氢化物的稳定性:HF>HCl>H2S
③还原性:S2->Cl->Br-
④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
3.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 根据化学反应速率的大小可以知道化学反应的相对快慢 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.