题目内容
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
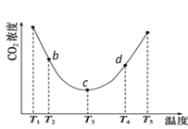
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
【答案】(2a+b)/3 0.2 mol/(L·min) 1.8 CD < K b>K c >Kd T3-T4 区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于 CO2 的捕获
【解析】
(1)根据盖斯定律分析解答;
(2)甲容器15min后达到平衡,此时CO2的转化率为75%,则转化CO2为8mol×75%=6mol,根据三段式分析计算;
(3)①具有碱性的物质能反应二氧化碳反应,能够捕获CO2;②c点是平衡点,正逆反应速率相同,根据温度对化学反应速率和平衡的影响分析解答。
(1)①Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H1=akJ/mol,②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=bkJ/mol,根据盖斯定律:![]() 可得Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故△H3=
可得Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故△H3=![]() =
=![]() kJ/mol,故答案为:
kJ/mol,故答案为:![]() ;
;
(2)甲容器15min后达到平衡,此时CO2的转化率为75%,则转化CO2为8mol×75%=6mol,列三段式:
CO2(g)+H2(g)CO(g)+H2O(g)
起始(mol/L):4 8 0 0
转化(mol/L):3 3 3 3
平衡(mol/L):1 5 3 3
则0~15min内平均反应速率v(CO2)=![]() =0.2mol/(Lmin);此条件下该反应的平衡常数K=
=0.2mol/(Lmin);此条件下该反应的平衡常数K=![]() =1.8,故答案为:0.2mol/(Lmin);1.8;
=1.8,故答案为:0.2mol/(Lmin);1.8;
(3)①A.Na2CO3 和二氧化碳反应生成碳酸氢钠,故A不符合;B.NaOH显碱性,可以吸收二氧化碳,故B不符合;C.CH3CH2OH 为中性分子不能和二氧化碳反应,不能吸收二氧化碳,故C符合;D.NH4Cl溶液显酸性,不能吸收二氧化碳,故D符合,故答案为:CD;
②I.温度越高,反应速率越快,d点温度高,则c点的逆反应速率和d点的正反应速率的大小关系为V逆c<V正d,故答案为:<;
II.根据图像,温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应是放热反应,升高温度,平衡逆向进行,平衡常数减小,Kb>Kc>Kd,故答案为:Kb>Kc>Kd;
III.T3-T4区间,化学反应已达到平衡,由于正反应是放热反应,温度升高,平衡向逆反应方向移动,不利于CO2的捕获,所以容器内CO2气体浓度呈现增大的变化趋势,故答案为: T3-T4区间,化学反应已达到平衡,由于正反应是放热反应,温度升高,平衡向逆反应方向移动,不利于CO2的捕获。

【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
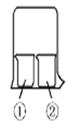
①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D
【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是_____,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____。
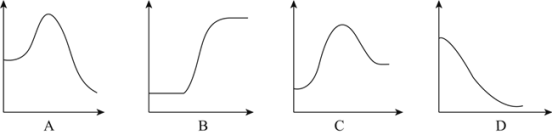
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________、_________________。