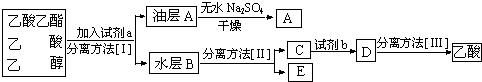
题目内容
5.现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,A元素原子的核外电子数与其所在周期数相等,B元素原子核外有3个能级上有电子,且每个能级上的电子数相同;D元素原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:(1)E元素基态原子的核外价层电子排布式为3d64s2
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序C<O<N.
(3)A元素与B、C元素可形成化合物B2A4、C2A4其分别结构式为
 、
、 .
.
分析 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,A元素原子的核外电子数与其所在周期数相等,则A为H元素;B元素原子核外有3个能级上有电子,且每个能级上的电子数相同,原子核外电子排布为1s22s22p2,故B为碳元素;D元素原子核外有8个运动状态不同的电子,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,只能处于第三周期,且E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,故E为Fe,F为Cu,据此解答.
解答 解:现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,A元素原子的核外电子数与其所在周期数相等,则A为H元素;B元素原子核外有3个能级上有电子,且每个能级上的电子数相同,原子核外电子排布为1s22s22p2,故B为碳元素;D元素原子核外有8个运动状态不同的电子,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,只能处于第三周期,且E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,故E为Fe,F为Cu.
(1)由上述分析可知,E为Fe元素,元素基态原子的核外价层电子排布式为3d64s2,故答案为:3d64s2;
(2)同周期随原子序数增大,元素第一电离能呈增大强酸,但氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,故答案为:C<O<N;
(3)A元素与B、C元素可形成化合物B2A4、C2A4分别为CH2=CH2、NH2-NH2,结构式分别为
分别结构式为 、
、 ,故答案为:
,故答案为: 、
、 .
.
点评 本题考查元素推断、核外电子排布、电离能、结构式等,推断元素是解题关键,注意同周期第一电离能异常情况.

| A. | 在周期表中,主族元素的主族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强 | |
| C. | 同主族元素随着原子的核电荷数的递增,原子半径依次增大 | |
| D. | 主族元素的单质,随相对分子质量的增大,熔、沸点升高 |
| A. | 酸和碱的物质的量一定相等 | |
| B. | 酸能够提供的H+与碱所能提供的OHˉ的物质的量相等 | |
| C. | 酸与碱的质量相等 | |
| D. | 溶液呈中性 |
| A. | 焦炭还原法 | B. | 湿法炼铜 | C. | 铝热还原法 | D. | 电解冶炼法 |
| A. | PCl5固体是分子晶体 | |
| B. | PCl5固体有良好的导电性 | |
| C. | PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1:1 | |
| D. | PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1:1 |
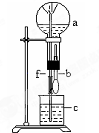
| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | NaHCO3溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
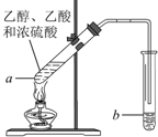 实验室制乙酸乙酯的主要装置如图所示,主要步骤为:
实验室制乙酸乙酯的主要装置如图所示,主要步骤为: