题目内容
13.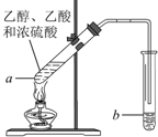 实验室制乙酸乙酯的主要装置如图所示,主要步骤为:
实验室制乙酸乙酯的主要装置如图所示,主要步骤为:①在a试管中按体积比2:3:2的比例配制浓硫酸、乙醇、乙酸的混合液;
②按图连接装置,小火加热a试管中的混合液,使产生的蒸气经导管通到b试管所盛饱和Na2CO3溶液中;
③待b试管中收集到约2mL产物时停止加热,撤下b试管并用力振荡,然后静置待其中液体分层;
④分离出纯净的乙酸乙酯.请回答下列问题:
(1)步骤①中,配制这一比例的混合液,三种药品加入的先后顺序是乙醇、浓硫酸、冰醋酸.
(2)写出CH3COOH、CH3CH218OH发生酯化反应的化学方程式:CH3COOH+CH3CH218OH→浓硫酸△CH3CO18OC2H5+H2O.
(3)步骤③中可观察到b试管中有细小气泡冒出.请写出该反应的离子方程式2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑
(4)该实验步骤④分离出乙酸乙酯的分离方法是分液
(5)若将浓硫酸、甲醇、乙醇、甲酸、乙酸五种物质按一定比例混合,在上图装置中进行酯化反应,则经步骤④分离出的酯类物质理论上有4种.
分析 (1)加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,所以18O原子反应后进入乙酸乙酯中;
(3)乙酸的酸性强于碳酸,所以二者反应生成二氧化碳气体;
(4)乙酸乙酯不溶于饱和碳酸钠溶液,所以混合液会分层,通过分液操作可以分离出乙酸乙酯;
(5)根据甲醇、乙醇分别与甲酸、乙酸发生酯化反应计算出生成酯的种类.
解答 解:(1)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,另外,加热时,试管内液体的体积不超过试管容积的“13”,加入药品的顺序为在一个30mL大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸和3mL乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀(药品总用量不能超过10mL),
故答案为:乙醇、浓硫酸、冰醋酸;
(2)实验中用含18O的乙醇与乙酸作用,酯化反应的本质为酸脱羟基,醇脱氢,所以乙酸脱羟基,乙醇脱氢离子,18O在产物乙酸乙酯中,反应的化学方程式为:CH3COOH+CH3CH218OH→浓硫酸△CH3CO18OC2H5+H2O,
故答案为:CH3COOH+CH3CH218OH→浓硫酸△CH3CO18OC2H5+H2O;
(3)步骤④中可观察到b试管中有细小的气泡冒出,那是生成了二氧化碳,因乙酸的酸性比碳酸强,所以乙酸能和碳酸钠反应生成二氧化碳气体,反应的离子方程式为:2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑,
故答案为:2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑;
(4)乙酸乙酯不溶于饱和碳酸钠溶液,所以混合液会分层,可通过分液存在分离出混合物中的乙酸乙酯,
故答案为:分液;
(5)甲醇与甲酸、乙酸分别生成甲酸甲酯、乙酸甲酯,乙醇与甲酸和乙酸分别生成甲酸乙酯和乙酸乙酯,所以总共能够生成4种酯类物质,
故答案为:4.
点评 本题考查了乙酸乙酯的制备,题目难度中等,注意把握乙酸乙酯的制备原理和实验方法为解答关键,试题培养了学生的分析、理解能力及化学实验能力.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 |
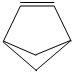
| A. | 盆烯的一氯取代物有5种 | B. | 盆烯能与氢气发生加成反应 | ||
| C. | 盆烯是苯的一种同分异构体 | D. | 盆烯是乙烯的一种同系物 |
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 甲苯(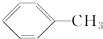 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| D. | 己烷的沸点高于2-甲基戊烷 |

| A. | 新旧平衡态时,A的体积分数相同 | |
| B. | 由旧平衡变为新平衡态,平衡常数不变 | |
| C. | 旧平衡态的v正与新平衡态的v逆相等 | |
| D. | t2时刻速率突变的原因是向密闭容器中加C或B |

 .
. 、
、 .
.