题目内容
14.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
分析 由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,$\frac{15}{3}$=5,且X与Z可形成XZ2分子,则X、Y、Z分别为C、N、O三种元素;根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,则出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;根据W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,推出W的质子数为$\frac{1}{2}$×(6+7+8+1)=11,所以W为Na元素,然后结合元素化合物及元素周期律来解答.
解答 解:由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,$\frac{15}{3}$=5,且X与Z可形成XZ2分子,则X、Y、Z分别为C、N、O三种元素;根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,则出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;根据W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,推出W的质子数为$\frac{1}{2}$×(6+7+8+1)=11,所以W为Na元素.
A.电子层越多,半径越多,同周期原子序数大的原子半径小,则原子半径应是W>X>Y>Z>M(即Na>C>N>O>H),故A错误;
B.选项中CO2、C2H2 均为直线型共价化合物,而Na2O2是离子化合物,不是直线型共价化合物,故B错误;
C.W与H形成的化合物为NaH,1molNaH与水反应生成1mol的H2,质量为2克,故C正确;
D、X、Y、Z、M四种元素可形成化合物 (NH4)2CO3、NH4HCO3、CO(NH2)2(尿素)等,前二种为离子化合物,而尿素为共价化合物,尿素中不含离子键,故D错误;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握信息及电子排布推断元素及元素化合物知识为解答的关键,侧重分析、推断及应用能力的考查,选项D为解答的易错点,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 将1mol氯气通入足量水中发生反应转移电子数为 NA | |
| C. | 585 g氯化钠晶体中约含有6.02×1022个氯化钠分子 | |
| D. | 常温下,200 ml、0.5 mol•L-1的Na2CO3溶液中阴离子数目等于0.1 NA |
| A. | 用H2O,C2H6表示的物质一定是纯净物 | |
| B. | 氯化钡的分子式BaCl2可以表示其组成 | |
| C. | 胶体区别于其它分散系的本质特征是丁达尔现象 | |
| D. | 质子数,中子数,电子数都相同的微粒一定是同一种粒子 |
| A. | SO2、SiO2、NO2均为酸性氧化物 | |
| B. | 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、甲苯均为电解质 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,碳棒上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,在电路中通过0.5mol电子后反接,又通过1mol电子,此时溶液中的c(H+)是2mol•L-1(假定溶液体积不变) |
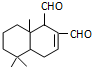
| A. | H2 | B. | Ag(NH3)2OH溶液 | C. | HBr | D. | Br2的CCl4溶液 |
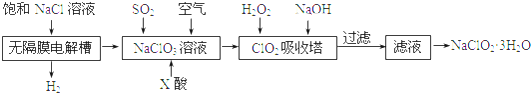
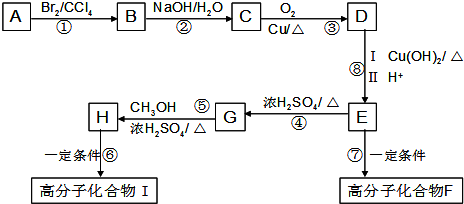
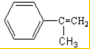 (2)E中的官能团名称是羟基、羧基
(2)E中的官能团名称是羟基、羧基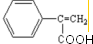 (4)反应②、④的反应类型分别是取代反应、消去反应
(4)反应②、④的反应类型分别是取代反应、消去反应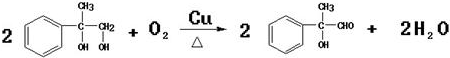 ;反应⑦n
;反应⑦n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$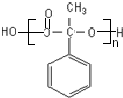 +(n-1)H2O;
+(n-1)H2O;