题目内容
4.亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀毒.以下是制取亚铝酸钠的工艺流程: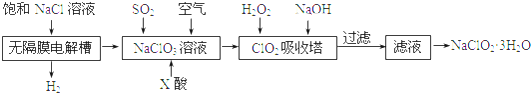
已知:
①NaClO2 的溶解度随着温度升高而增大,适当条件下可结晶析出.
②ClO2气体在中性和碱性溶液中不能稳定存在.
(1)在无隔膜电解槽中持续电解一段时间后,请写出阳极的电极反应方程式:Cl--6e-+6OH-=ClO3-+3H2O.生成ClO2 气体的反应中所加X酸为硫酸.
(2)吸收塔内的温度不能过高的原因为:防止H2O2分解 ClO2 吸收塔内发生反应的离子反应为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O.
(3)从滤液中得到NaClO2•3H2O粗晶体的操作步骤为蒸发浓缩、冷却结晶、过滤; 粗晶体进一步提纯的实验操作名称是重结晶.
(4)a kg 30% H2O2 理论上可最多制得2.55akg NaClO2•3H2O.
分析 无隔膜电解槽中持续电解饱和氯化钠溶液,则电解生成的氯气和氢氧化钠反应生成氯酸钠溶液,通二氧化硫和X酸还原氯酸钠溶液生成二氧化氯,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发结晶得到亚氯酸钠晶体.
(1)根据电解池中阳极失去电子结合产物书写;由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸;
(2)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,ClO 2 吸收塔内在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO 2,过氧化氢做还原剂被氧化为氧气;
(3)从溶液中得到含结晶水的晶体,是采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,粗晶体进一步提纯,再重新将粗晶体进行溶解,蒸发浓缩,冷却结晶,过滤洗涤,通过重结晶的方法提纯;
(4)依据反应2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O的定量关系计算得到晶体理论质量.
解答 解:(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,因此反应的电极反应式是Cl--6e-+6OH-=ClO3-+3H2O,由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸,
故答案为:Cl--6e-+6OH-=ClO3-+3H2O;硫酸;
(2)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,ClO2 吸收塔内在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO 2,过氧化氢做还原剂被氧化为氧气,反应的离子方程式为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
故答案为:防止H2O2分解;2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)NaClO 2 的溶解度随着温度升高而增大,适当条件下可结晶析出,从滤液中得到NaClO 2•3H 2 O粗晶体,是从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,粗晶体进一步提纯,再重新将粗晶体进行溶解,蒸发浓缩,冷却结晶,过滤洗涤,通过重结晶的方法提纯;
故答案为:蒸发浓缩、冷却结晶、过滤;重结晶;
(4)设理论生成NaClO2•3H2O的质量为m,则
H2O2~2ClO2-~2NaClO2•3H2O
34 289
a kg×30% m
m=$\frac{akg×30%×289}{34}$=2.55akg,
故答案为:2.55a.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.

| A. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 甲醇燃料电池(KOH作电解质溶液)的负极反应式:CH3OH-6e+H2O=CO2+6H+ | |
| C. | 红热的铁丝与水接触,表面形成黑色保护层:3Fe+4H2O=Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
| A. | 加锌盐 | B. | 加碘盐 | C. | 加钙盐 |
| A. | 向溶液中加水稀释至10 L | B. | 加入一定量的NaOH固体 | ||
| C. | 加入一定量pH=8的NaOH溶液 | D. | 加入一定浓度的盐酸 |
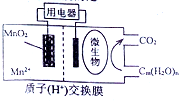 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )| A. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g. |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
 实验室中只有0.1000mol•L-1的酸性KMnO4溶液,甲同学用下图所示操作配制100mL0.0010mol•L-1的KMnO4溶液,指出其中的两处错误称取酸性高锰酸钾选用碱式滴定管、在容量瓶稀释浓溶液.
实验室中只有0.1000mol•L-1的酸性KMnO4溶液,甲同学用下图所示操作配制100mL0.0010mol•L-1的KMnO4溶液,指出其中的两处错误称取酸性高锰酸钾选用碱式滴定管、在容量瓶稀释浓溶液.
 .
. +
+ $\stackrel{H+}{?}$
$\stackrel{H+}{?}$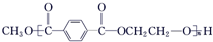 +(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.
+(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.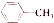 合成
合成 的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:
的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图: