题目内容
3.Ⅰ、当0.2mol烃A在足量氧气中完全燃烧时生成CO2和H2O各1.2mol,催化加氢后生成2,2-二甲基丁烷,则A的结构简式为(CH3)3C-CH=CH2.Ⅱ、某烃1mol与2molHCl完全加成,生成的氯代烷最多还可以与4molCl2反应,则该烃的结构简式为CH≡CH.
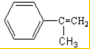
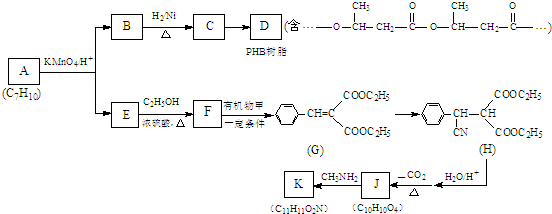
Ⅲ、某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其最大质荷比为118;其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;其苯环上只有一个取代基.以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题:
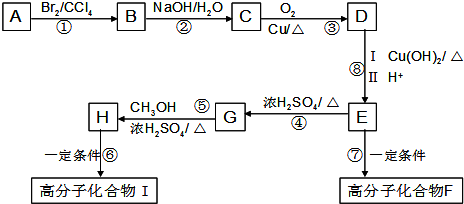
(1)A的结构简式为
 (2)E中的官能团名称是羟基、羧基
(2)E中的官能团名称是羟基、羧基(3)G的结构简式为
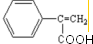 (4)反应②、④的反应类型分别是取代反应、消去反应
(4)反应②、④的反应类型分别是取代反应、消去反应(5)反应⑥、⑦生成的高分子化合物的反应原理是否相同?否(填“是”或“否”)
(6)写出下列反应的化学方程式:反应③
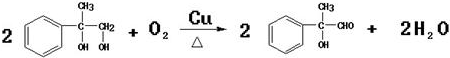 ;反应⑦n
;反应⑦n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$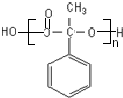 +(n-1)H2O;
+(n-1)H2O;(7)符合以下条件的C的同分异构体有5种(不考虑立体异构)
a、苯环上有两个取代基
b、苯环上的一氯代物有两种
c、加入三氯化铁溶液显色
d、向1mol该物质中加入足量的金属钠可产生1mol氢气.
分析 Ⅰ、根据C元素、H元素守恒确定该烃的分子式为C6H12,在催化剂作用下与H2发生加成反应,生成2,2-二甲基丁烷,则该烃的结构简式为(CH3)3C-CH=CH2;
Ⅱ、烃1mol与2mol HCl完全加成,则该烃分子有2个双键或1个三键,1mol氯代烷能和4mol氯气发生完全取代反应,则氯代烷分子中有4个H原子,所以原烃分子中有2个H原子,据此确定;
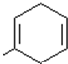
Ⅲ、通过质谱法测得芳香烃A的相对分子质量为118,其苯环上只有一个取代基,其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;则A物质只能为: ,因此物质A与溴的四氯化碳溶液可发生加成反应得到卤代物B,卤代物在氢氧化钠的水溶液中发生取代反应生成物质:C
,因此物质A与溴的四氯化碳溶液可发生加成反应得到卤代物B,卤代物在氢氧化钠的水溶液中发生取代反应生成物质:C ,醇在铜做催化剂,与氧气反应生成对应的醛即物质:D
,醇在铜做催化剂,与氧气反应生成对应的醛即物质:D ;醛与氢氧化铜做氧化剂的条件下,被氧化生成对应的酸:E
;醛与氢氧化铜做氧化剂的条件下,被氧化生成对应的酸:E ,而E物质在浓硫酸条件下,
,而E物质在浓硫酸条件下, 可脱去羟基,生成物质:G
可脱去羟基,生成物质:G ,物质G在浓硫酸的条件下,能与甲醇发生酯化反应生成物质:H 2-苯基丙烯酸甲酯;物质H可发生加聚反应生成物质I:
,物质G在浓硫酸的条件下,能与甲醇发生酯化反应生成物质:H 2-苯基丙烯酸甲酯;物质H可发生加聚反应生成物质I: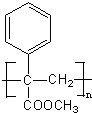 ;化合物E
;化合物E 即含羧基由含羟基,发生缩聚反应生成F
即含羧基由含羟基,发生缩聚反应生成F ,据此进行解答.
,据此进行解答.
解答 解:Ⅰn(烃):n(C):n(H)=n(烃):n(CO2):2n(H2O)=0.2mol:1.2mol:1.2mol×2=1:6:12,即1个分子中含有6个C原子、12个H原子,故该烃的分子式为C6H12,在催化剂作用下与H2发生加成反应,生成2.2-二甲基丁烷,则该烃的结构简式为:(CH3)3C-CH=CH2,
故答案为:(CH3)3C-CH=CH2;
Ⅱ、烃1mol与2mol HCl完全加成,则该烃分子有2个双键或1个三键,1mol氯代烷能和4mol氯气发生完全取代反应,则氯代烷分子中有4个H原子,氯代烷分子中有2个H原子是烃与氯化氢加成引入的,所以原烃分子中有2个H原子,故该烃为CH≡CH,
故答案为:CH≡CH;
Ⅲ、通过质谱法测得芳香烃A的相对分子质量为118,其苯环上只有一个取代基,则A物质只能为: ,因此物质A与溴的四氯化碳溶液可发生加成反应得到卤代物B,卤代物在氢氧化钠的水溶液中发生取代反应生成物质C:
,因此物质A与溴的四氯化碳溶液可发生加成反应得到卤代物B,卤代物在氢氧化钠的水溶液中发生取代反应生成物质C: ,醇在铜做催化剂,与氧气反应生成对应的醛即物质D:
,醇在铜做催化剂,与氧气反应生成对应的醛即物质D: ;醛与氢氧化铜做氧化剂的条件下,被氧化生成对应的酸,即物质E:
;醛与氢氧化铜做氧化剂的条件下,被氧化生成对应的酸,即物质E: ,而E物质在浓硫酸条件下,
,而E物质在浓硫酸条件下, 可脱去羟基,生成物质:G 2-苯基丙烯酸,物质G在浓硫酸的条件下,能与甲醇发生酯化反应生成物质:H 2-苯基丙烯酸甲酯;物质H可发生加聚反应生成物质I:
可脱去羟基,生成物质:G 2-苯基丙烯酸,物质G在浓硫酸的条件下,能与甲醇发生酯化反应生成物质:H 2-苯基丙烯酸甲酯;物质H可发生加聚反应生成物质I: ,化合物E
,化合物E 即含羧基由含羟基,发生缩聚反应生成F
即含羧基由含羟基,发生缩聚反应生成F ,
,
(1)根据以上分析可知,A的结构简式为: ,故答案为:
,故答案为: ;
;
(2)根据以上分析可知,E的结构简式为 ,该有机物分子中含有的官能团为羟基、羧基,
,该有机物分子中含有的官能团为羟基、羧基,
故答案为:羟基、羧基;
(3)根据分析可知,G的结构简式为: ,故答案为:
,故答案为: ;
;
(4)根据分析可知,反应②为卤代物在氢氧化钠的水溶液中发生取代反应生成物质C;反应④为E物质在浓硫酸条件下, 脱去羟基发生消去反应生成物质G,故答案为:取代反应、消去反应;
脱去羟基发生消去反应生成物质G,故答案为:取代反应、消去反应;
(5)根据以上分析,反应⑥H因为含有碳碳双键所以为加聚生成高分子I,⑦为化合物E 因为含羧基由含羟基,所以发生缩聚反应生成高分子F,所以生成的高分子化合物的反应原理是不相同,故答案为:否;
因为含羧基由含羟基,所以发生缩聚反应生成高分子F,所以生成的高分子化合物的反应原理是不相同,故答案为:否;
(6)反应③为 催化氧化生成
催化氧化生成 ,反应的化学方程式为:
,反应的化学方程式为: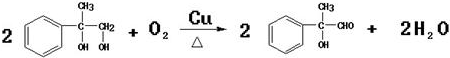 ,
,
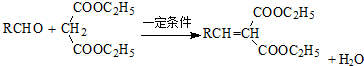
反应⑦为 在一定条件下转化成高分子F
在一定条件下转化成高分子F ,反应的化学方程式为:n
,反应的化学方程式为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O;故答案为:
+(n-1)H2O;故答案为: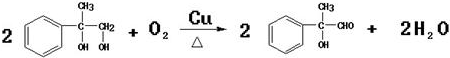 ;n
;n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O;
+(n-1)H2O;
(7)C为 的同分异构体a、苯环上有两个取代基;b、苯环上的一氯代物有两种,则为对位结构;c、加入三氯化铁溶液显色,说明其中一个取代基为酚羟基;d、向1mol该物质中加入足量的金属钠可产生1mol氢气,说明另一个还含有一个羟基,则符合条件的取代基可能为-OH和-CH2CH2CH2OH,或者-OH和-CH2CHOHCH3,或者-OH和-CHOHCH2CH3,或者-OH和-CH(CH3)CH2OH,或者-OH和-COH(CH3)2,共5种,故答案为:5.
的同分异构体a、苯环上有两个取代基;b、苯环上的一氯代物有两种,则为对位结构;c、加入三氯化铁溶液显色,说明其中一个取代基为酚羟基;d、向1mol该物质中加入足量的金属钠可产生1mol氢气,说明另一个还含有一个羟基,则符合条件的取代基可能为-OH和-CH2CH2CH2OH,或者-OH和-CH2CHOHCH3,或者-OH和-CHOHCH2CH3,或者-OH和-CH(CH3)CH2OH,或者-OH和-COH(CH3)2,共5种,故答案为:5.
点评 本题考查了有机推断及有机合成,题目难度较大,正确理解题干信息及合成原理为解答关键,注意掌握常见有机物结构与性质,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

 阅读快车系列答案
阅读快车系列答案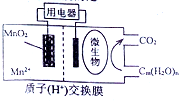 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )| A. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g. |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在硅酸钠溶液中滴入稀盐酸,溶液变浑浊. | 非金属性:Cl>Si |
| B | C2H5Br与Br2的溶液混合中加入Na2SO3溶液充分振荡后分液 | 除去C2H5Br中的溴 |
| C | 向某溶液中加氯化钡溶液产生白色沉淀,再加稀硝酸沉淀不消失 | 说明原溶液中一定含有 SO42- |
| D | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去 | 证明生成的气体全部是 乙烯 |
| A. | A | B. | B | C. | C | D. | D |
工业上可用如下方法合成甲醇:
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)方法一生产甲醇是目前工业上常用的方法.在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%.请回答下列问题:
①前5分钟内甲醇的平均反应速率为0.08mol/(L•min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②在该温度下反应的平衡常数K=100.
③在图甲方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线.

(画在答题纸上)
④关于上述反应,下列叙述不正确的是A(填编号).
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,则此时v正>v逆
(3)方法二生产甲醇应更具前景,写出方法二生产甲醇的一个优点减少二氧化碳的排放,有效控制温室效应.
(4)根据反应2CH3OH(g)?CH3OCH3(g)+H2O(g),可利用CH3OH生产CH3OCH3.
有人对甲醇脱水转化为二甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得图乙2幅图.
根据以上两幅图选择不受空速影响的合适反应温度和压强320℃、0.2-0.6Mpa.
(5)根据文献,甲醇生产二甲醚的转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇).若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率xM=$\frac{32C{\;}_{W}}{32C{\;}_{W}+9C{\;}_{M}}$.
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3•H2O)=1×10-4mol•L-1 | |
| B. | 由CH3COOH与CH3COONa组成的pH=5.6的混合溶液中:c(Na+)<c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<② |
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO和SO2 | D. | NO2和SO2 |
| A. | 1molCl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1LpH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21g乙烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol${\;}_{6}^{14}$C原子中所含中子数目为6NA |
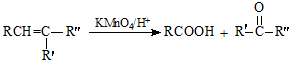
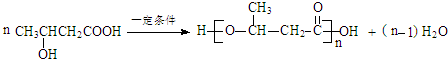 .
. .
. .
. .
.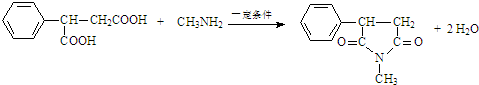 .
.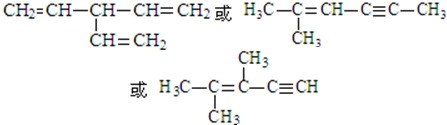 (写出一种即可).
(写出一种即可).