题目内容
4.某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目减少,则该试剂是( )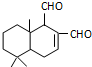
| A. | H2 | B. | Ag(NH3)2OH溶液 | C. | HBr | D. | Br2的CCl4溶液 |
分析 A.碳碳双键、醛基都发生加成反应;
B.醛基和银氨溶液发生氧化反应生成羧基;
C.碳碳双键发生加成反应;
D.碳碳双键发生加成反应,醛基和溴发生氧化反应.
解答 解:A.碳碳双键、醛基都发生加成反应,生成物只有羟基,官能团数目减少,故A正确;
B.醛基和银氨溶液发生氧化反应生成羧基,官能团数目不变,故B错误;
C.碳碳双键和HBr发生加成反应,官能团由碳碳双键变为溴原子,HBr和醛基不反应,所以官能团数目不变,故C错误;
D.碳碳双键发生加成反应,醛基和溴发生氧化反应,所以增加溴原子,故D错误.
故选A.
点评 本题考查了有机物的结构及性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物中含有的官能团及其性质,明确物质能发生哪些类型的反应,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
14.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
15.向BaCl2溶液中通入物质的量之比为1:2的某混合气体,无沉淀产生,则该混合气体是( )
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO和SO2 | D. | NO2和SO2 |
12.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molCl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1LpH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21g乙烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol${\;}_{6}^{14}$C原子中所含中子数目为6NA |
19.下列说法正确的是( )
| A. | 粗锌与稀硫酸反应比纯锌快,说明粗锌中含有更活泼的金属 | |
| B. | 新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 | |
| C. | 常温下,弱酸酸式盐NaHA的pH=6,说明HA-的电离程度大于其水解程度 | |
| D. | 一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的△H<0,△S>0 |
16. 有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
 有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A. | 电极a是正极,电极反应式为CH4+4O2--8e-=CO2+2H2O | |
| B. | 电极b是正极,O2-由电极b流向电极a | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b | |
| D. | 当电路中有0.4mol电子转移时,a极有2.24L(标况)甲烷放电 |
14. 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )| A. | HMX分子式为C4N8O8 | |
| B. | HMX中,所有C、N原子共平面 | |
| C. | 爆炸反应是,N2既是还原产物又是氧化产物 | |
| D. | 29.6gHMX完全燃烧产生二氧化碳8.96L |



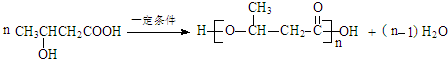 .
.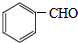 .
. .
.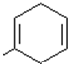 .
.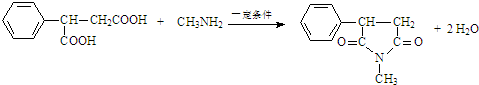 .
.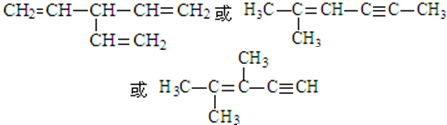 (写出一种即可).
(写出一种即可).