题目内容
2.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 将1mol氯气通入足量水中发生反应转移电子数为 NA | |
| C. | 585 g氯化钠晶体中约含有6.02×1022个氯化钠分子 | |
| D. | 常温下,200 ml、0.5 mol•L-1的Na2CO3溶液中阴离子数目等于0.1 NA |
分析 A.过氧化钠中含有2个钠离子和1个过氧根离子,氧化钠中含有2个钠离子和1过氧离子;
B.将1mol氯气通入足量水中,只有少量的氯气与水反应生成氯化氢和次氯酸;
C.氯化钠是离子化合物;
D.碳酸根离子发生水解,溶液中阴离子数增多.
解答 解:A.1mol Na2O和Na2O2的混合物中含有2mol钠离子和1mol阴离子,总共含有3mol阴、阳离子,故含有的阴、阳离子总数是3NA,故A正确;
B.将1mol氯气通入足量水中,由于只有部分氯气与水反应生成氯化氢和次氯酸,所以反应转移的电子小于1mol,转移的电子数小于NA,故B错误;
C.氯化钠晶体由钠离子和氯离子构成,不含分子,故C错误;
D.200mL 0.5mol•L-1的Na2C03溶液中,碳酸根离子水解生成氢氧根离子和碳酸氢根离子,阴离子增多,溶液中阴离子数目大于0.1NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的应用,难度中等.B为易错点,注意氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
13.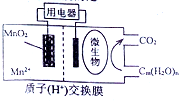 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )| A. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g. |
7.常温下,下列叙述正确的是( )
| A. | 1.0×10-3 mol•L-1盐酸的pH=3.0,1.0×10-7.5 mol•L-1盐酸的pH=7.5 | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 在醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b | |
| D. | 若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
14.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
11.下表中的实验操作能达到实验目的或能得出相应结论的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在硅酸钠溶液中滴入稀盐酸,溶液变浑浊. | 非金属性:Cl>Si |
| B | C2H5Br与Br2的溶液混合中加入Na2SO3溶液充分振荡后分液 | 除去C2H5Br中的溴 |
| C | 向某溶液中加氯化钡溶液产生白色沉淀,再加稀硝酸沉淀不消失 | 说明原溶液中一定含有 SO42- |
| D | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去 | 证明生成的气体全部是 乙烯 |
| A. | A | B. | B | C. | C | D. | D |
12.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molCl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1LpH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21g乙烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol${\;}_{6}^{14}$C原子中所含中子数目为6NA |
 实验室中只有0.1000mol•L-1的酸性KMnO4溶液,甲同学用下图所示操作配制100mL0.0010mol•L-1的KMnO4溶液,指出其中的两处错误称取酸性高锰酸钾选用碱式滴定管、在容量瓶稀释浓溶液.
实验室中只有0.1000mol•L-1的酸性KMnO4溶液,甲同学用下图所示操作配制100mL0.0010mol•L-1的KMnO4溶液,指出其中的两处错误称取酸性高锰酸钾选用碱式滴定管、在容量瓶稀释浓溶液.
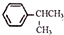 可写成
可写成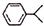
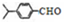 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;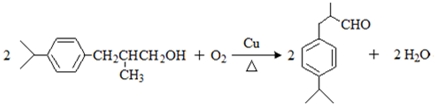 .
.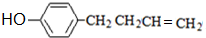 .
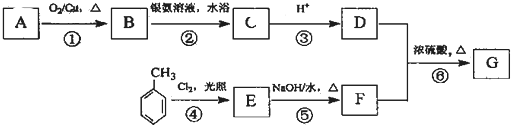
.
 ;
; .
.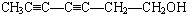 或
或 或
或 .
.