题目内容
9.下列关于化学基本概念的认识中正确的是( )| A. | 用H2O,C2H6表示的物质一定是纯净物 | |
| B. | 氯化钡的分子式BaCl2可以表示其组成 | |
| C. | 胶体区别于其它分散系的本质特征是丁达尔现象 | |
| D. | 质子数,中子数,电子数都相同的微粒一定是同一种粒子 |
分析 A、一种物质组成的为纯净物,H2O,C2H6表示的只是一种物质;
B、氯化钡属于盐,是离子化合物,不存在分子式;
C、分散系的本质区别在于分散质微粒的直径大小,能通过滤纸的分散系为溶液、胶体;能通过半透膜的分散系是溶液;
D、质子数、中子数和电子数都相同的微粒不一定是同一种粒子.
解答 解:A、C2H6为乙烷表示的只是一种物质属于纯净物,H2O是表示的纯净物,故A正确;
B、氯化钡属于盐,是离子化合物,不存在分子式,BaCl2表示其组成比是化学式,故B错误;
C、胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm(10-7~10-9m)之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm,故C错误;
D.质子数、中子数和电子数都相同的微粒不一定是同一种粒子,如铵根离子和钠离子,CO和N2,故D错误,
故选A.
点评 本题考查了物质分类,分散系特征,微粒的结构特征,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
4.同时加热氯化镁晶体(MgCl2•6H2O)和硫酸镁晶体(MgSO4•7H2O)时,氯化镁易发生水解反应,其原因是( )
| A. | 硫酸镁晶体分解反应是放热反应 | B. | 氯化镁水解是熵增反应 | ||
| C. | 硫酸镁晶体分解反应是熵减反应 | D. | 氯化镁分解放热比硫酸镁少 |
14.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
1.已知在热的碱性溶液中,Cl2发生如下反应:Cl2+NaOH→NaCl+NaClO3+H2O(未配平).请推测NaClO2在热的碱性溶液中发生反应的最终产物是( )
| A. | NaCl、NaClO | B. | NaCl、NaClO3 | C. | NaClO、NaClO3 | D. | NaClO3、NaClO4 |
18.甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.
工业上可用如下方法合成甲醇:
(1)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)方法一生产甲醇是目前工业上常用的方法.在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%.请回答下列问题:
①前5分钟内甲醇的平均反应速率为0.08mol/(L•min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②在该温度下反应的平衡常数K=100.
③在图甲方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线.

(画在答题纸上)
④关于上述反应,下列叙述不正确的是A(填编号).
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,则此时v正>v逆
(3)方法二生产甲醇应更具前景,写出方法二生产甲醇的一个优点减少二氧化碳的排放,有效控制温室效应.
(4)根据反应2CH3OH(g)?CH3OCH3(g)+H2O(g),可利用CH3OH生产CH3OCH3.
有人对甲醇脱水转化为二甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得图乙2幅图.
根据以上两幅图选择不受空速影响的合适反应温度和压强320℃、0.2-0.6Mpa.
(5)根据文献,甲醇生产二甲醚的转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇).若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率xM=$\frac{32C{\;}_{W}}{32C{\;}_{W}+9C{\;}_{M}}$.
工业上可用如下方法合成甲醇:
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)方法一生产甲醇是目前工业上常用的方法.在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%.请回答下列问题:
①前5分钟内甲醇的平均反应速率为0.08mol/(L•min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②在该温度下反应的平衡常数K=100.
③在图甲方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线.

(画在答题纸上)
④关于上述反应,下列叙述不正确的是A(填编号).
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,则此时v正>v逆
(3)方法二生产甲醇应更具前景,写出方法二生产甲醇的一个优点减少二氧化碳的排放,有效控制温室效应.
(4)根据反应2CH3OH(g)?CH3OCH3(g)+H2O(g),可利用CH3OH生产CH3OCH3.
有人对甲醇脱水转化为二甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得图乙2幅图.
根据以上两幅图选择不受空速影响的合适反应温度和压强320℃、0.2-0.6Mpa.
(5)根据文献,甲醇生产二甲醚的转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇).若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率xM=$\frac{32C{\;}_{W}}{32C{\;}_{W}+9C{\;}_{M}}$.
19.下列说法正确的是( )
| A. | 粗锌与稀硫酸反应比纯锌快,说明粗锌中含有更活泼的金属 | |
| B. | 新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 | |
| C. | 常温下,弱酸酸式盐NaHA的pH=6,说明HA-的电离程度大于其水解程度 | |
| D. | 一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的△H<0,△S>0 |
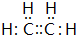 ,A的结构简式H2C=CH2.
,A的结构简式H2C=CH2. ,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.
,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.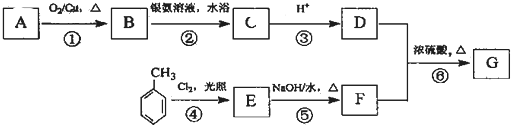
 ;
; .
.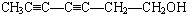 或
或 或
或 .
.