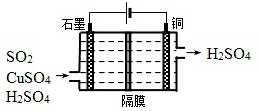
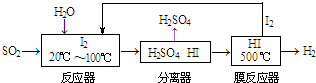
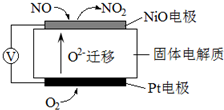
题目内容
19.下列物质分类正确的是( )| A. | SO2、SiO2、NO2均为酸性氧化物 | |
| B. | 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、甲苯均为电解质 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
分析 A、酸性氧化物是能与碱反应生成盐和水的氧化物,NO2不是酸性氧化物;
B、分散质微粒直径在1-100nm,在分散剂中形成的分散系为胶体,分散质小于1nm形成的分散系为溶液;
C、电解质是水溶液中或熔融状态下导电的化合物;
D、福尔马林是甲醛的水溶液,水玻璃是硅酸钠的水溶液,氨水是氨气的水溶液;
解答 A、酸性氧化物是能与碱反应生成盐和水的氧化物,NO2和碱反应生成盐和水发生的是氧化还原反应,NO2不是酸性氧化物,故A错误;
B、稀豆浆、鸡蛋清溶液均为胶体,氯化铁溶液是溶液不是胶体,故B错误;
C、常见的电解质有酸、碱、盐、金属氧化物和水,烧碱、冰醋酸为电解质,甲苯为非电解质,故C错误;
D、福尔马林是甲醛的水溶液,水玻璃是硅酸钠的水溶液,氨水是氨气的水溶液,故均为混合物,故D正确;
故选D.
点评 本题考查了酸性氧化物、化合物、电解质和胶体、单质的概念和辨析,注意物质组成和概念的实质理解应用,难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
9.现有pH=5的CH3COOH溶液10mL,要使其pH增大3,可采取的方法有( )
| A. | 向溶液中加水稀释至10 L | B. | 加入一定量的NaOH固体 | ||
| C. | 加入一定量pH=8的NaOH溶液 | D. | 加入一定浓度的盐酸 |
7.常温下,下列叙述正确的是( )
| A. | 1.0×10-3 mol•L-1盐酸的pH=3.0,1.0×10-7.5 mol•L-1盐酸的pH=7.5 | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 在醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b | |
| D. | 若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
14.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
4.四种短周期元素在周期表中的位置如图,其中Y的最高价氧化物对应的水化物能与其氢化物反应生成盐.下列说法正确的是( )
| Y | |||
| M | X | Z |
| A. | 钠与Z可能形成只含离子键的Na2Z、Na2Z2化合物 | |
| B. | X的最高价氧化物不与任何酸反应 | |
| C. | Y的最简单气态氢化物的热稳定性比X的强,因为Y的最简单气态氢化物分子间存在氢键 | |
| D. | M的简单离子半径是同周期中简单离子半径最小的 |
11.下表中的实验操作能达到实验目的或能得出相应结论的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在硅酸钠溶液中滴入稀盐酸,溶液变浑浊. | 非金属性:Cl>Si |
| B | C2H5Br与Br2的溶液混合中加入Na2SO3溶液充分振荡后分液 | 除去C2H5Br中的溴 |
| C | 向某溶液中加氯化钡溶液产生白色沉淀,再加稀硝酸沉淀不消失 | 说明原溶液中一定含有 SO42- |
| D | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去 | 证明生成的气体全部是 乙烯 |
| A. | A | B. | B | C. | C | D. | D |
8.(双项)常温下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3•H2O)=1×10-4mol•L-1 | |
| B. | 由CH3COOH与CH3COONa组成的pH=5.6的混合溶液中:c(Na+)<c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<② |

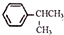 可写成
可写成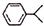
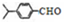 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;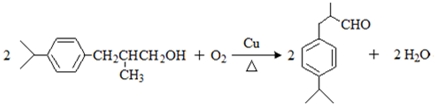 .
.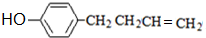 .
.