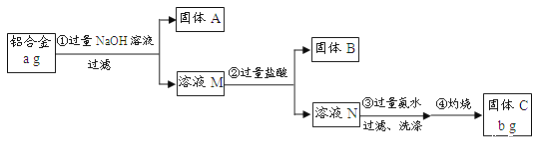
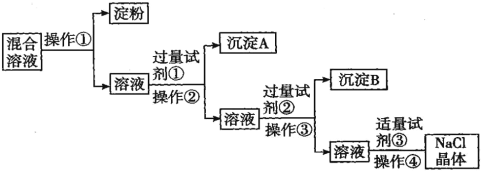
题目内容
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)从煤油中取出一块钠,用滤纸吸净其表面的煤油,用小刀切下一小块,钠块表面很快变暗,该反应的氧化产物为__________;将一小块钠放入坩埚中加热,反应现象为:________________________,反应的化学方程式是______________________。以上反应表明金属钠具有强的______性(填“氧化”或 “还原”)。
(2)铝和氢氧化钠反应的化学方程式为:___________________________________;如果产生的气体在标准状态下的体积为2.24L,即反应转移的电子数为____NA;
(3)已知: Fe2O3+2Al![]() Al2O3+2Fe,该反应中作为还原剂的是________,还原产物是 _______;标出电子转移的方向和数目_______________________________。
Al2O3+2Fe,该反应中作为还原剂的是________,还原产物是 _______;标出电子转移的方向和数目_______________________________。
【答案】氧化钠(Na2O) 钠块熔化并燃烧,产生黄色火焰,有淡黄色固体生成 2Na+O2![]() Na2O2 还原 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 0.2 Al Fe
Na2O2 还原 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 0.2 Al Fe ![]()
【解析】
(1)Na具有很强的还原性,能在空气中的发生氧化反应生成氧化钠;在空气中燃烧,产生黄色火焰,生成淡黄色固体;
(2)铝和氢氧化钠反应生成偏铝酸钠和氢气;
(3)反应中Al的化合价由0价变为+3价,作还原剂;氧化铁作氧化剂,生成的Fe为还原产物。
(1)Na具有很强的还原性,能在空气中的发生氧化反应生成氧化钠;在空气中加热钠块熔化并燃烧,产生黄色火焰,有淡黄色固体生成,方程式为2Na+O2![]() Na2O2;
Na2O2;
(2)铝和氢氧化钠反应生成偏铝酸钠和氢气,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;产生标况下的2.24L的氢气,即0.1mol,转移电子数目为0.2NA;
(3)反应中Al的化合价由0价变为+3价,作还原剂;氧化铁作氧化剂,生成的Fe为还原产物;用单线桥法表示为![]() 。
。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
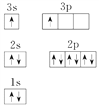
优翼小帮手同步口算系列答案【题目】现有部分前36号元素的性质或原子结构如下表
元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
【答案】 氮原子2p轨道半充满,能量低,稳定 否 F的电负性最大,只能得电子 2s22p5 2  能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
【解析】试题分析:R元素的基态原子最外层有3个未成对电子,次外层有2个电子,R是N元素;S元素的单质能与水剧烈反应,所得溶液呈弱酸性,S是F元素;T元素的基态原子3d轨道上有1个电子,T是21号元素Sc; X元素的原子核外有12个电子,X是Mg元素。
解析:根据以上分析,(1)R是N元素,氮原子2p轨道半充满,能量低,稳定,所以第一电离能要大于其同周期相邻的O元素。
(2)元素F的电负性最大,只能得电子,所以F元素没有正价;F元素的最外层电子排布式为2s22p5。
(3)Sc原子的核外电子排布式是1s22s22p63s23p63d14s2,所以N能层上电子数为2,其原子结构示意图为 。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
【题型】综合题
【结束】
20
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。