题目内容
【题目】某研究性学习小组为了测定某品牌铝合金中铝的含量,现设计了如下实验:
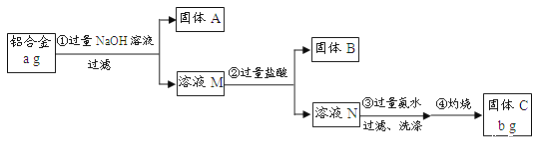
已知:该铝合金的主要成分为Al2O3、MgO、CuO、SiO2。
请回答下列问题:
(1)固体A的成分是_______;
(2)生成固体B的化学方程式为_____;步骤③中生成沉淀的离子方程式为_____;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为______;
(4)该样品中铝的质量分数是______;(用a、b表示)
【答案】MgO、CuO Na2SiO3+2HCl=2NaCl+H2SiO3↓ Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净 ![]() ×100%
×100%
【解析】
该铝合金的主要成分为Al2O3、MgO、CuO、SiO2,加入过量氢氧化钠溶液,只有Al2O3、SiO2与过量的NaOH溶液反应,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,过滤,固体A为MgO、CuO溶液M为NaAlO2、Na2SiO3,溶液M中加入过量盐酸,发生反应的方程式为:Na2SiO3+2HCl=2NaCl+H2SiO3↓,NaAlO2+4HCl(过量)=NaCl+AlCl3+2H2O,所以过滤得到固体B为H2SiO3,溶液N中为AlCl3溶液,加入过量氨水,发生的反应为:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl,过滤洗涤得到氢氧化铝沉淀,灼烧得到固体C为Al2O3,据此答题。
(1)根据分析可知:固体A为MgO、CuO,故答案为:。
(2)固体B为硅酸钠和盐酸反应生成硅酸沉淀,反应的化学方程式为:Na2SiO3+2HCl=2NaCl+H2SiO3↓,步骤③是氯化铝和一水合氨反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故答案为:Na2SiO3+2HCl=2NaCl+H2SiO3↓,Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(3)沉淀表面沾有氯化铵、氯化钠溶液,检验最后一次洗涤液中是否含有氯离子,设计实验证明:取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净;故答案为:取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净。
(4)由分析分析可知bg固体C为Al2O3,依据铝元素守恒计算,铝的质量分数=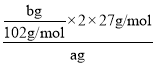 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。