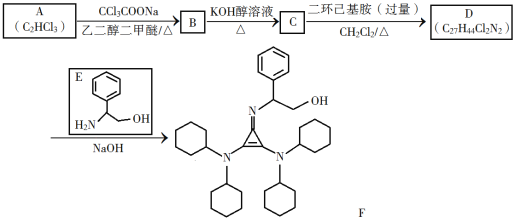
题目内容
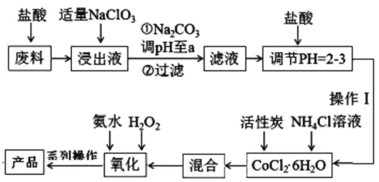
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
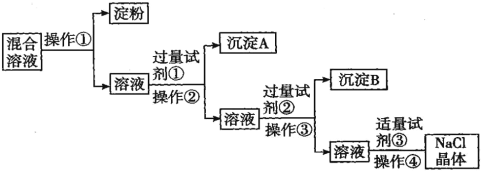
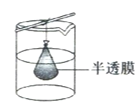
(1)操作①的名称是___________
(2)试剂①的化学式是____________ 判断试剂①已过量的方法是:________________________
(3)加入试剂②发生的离子方程式是____________________________________。
(4)操作④的名称是:_____________
【答案】渗析 BaCl2溶液 取上层清液于试管中,滴加氯化钡溶液无白色沉淀出现,则氯化钡溶液过量 Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓ 蒸发结晶
【解析】
溶液与胶体的本质区别为分散质微粒的直径大小不一样,溶液可透过半透膜,通过渗析可分离淀粉和溶液;除去溶液中的硫酸根离子,需用氯化钡溶液,而除去溶液中过量的钙离子与钡离子都需要加入碳酸钠溶液除去,故除硫酸根离子在除钙离子之前,则试剂①为氯化钡溶液,操作②为过滤,沉淀A为硫酸钡;试剂②为碳酸钠溶液,操作③为过滤,沉淀B为碳酸钙、碳酸钠;溶液加入稍过量的盐酸即可除去过量的碳酸根离子,再加热蒸发结晶即可得到NaCl晶体。
(1)操作①为分离胶体和溶液,操作名称为渗析;
(2)试剂①为除去溶液中的硫酸根离子,加入试剂为氯化钡溶液;氯化钡过量时,溶液中无硫酸根离子,则取上层清液于试管中,滴加氯化钡溶液无沉淀出现,则氯化钡溶液过量;
(3)试剂②为碳酸钠溶液,其和溶液中的钡离子、钙离子反应生成碳酸钡和碳酸钙沉淀,反应的离子方程式为Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓;
(4)氯化钠溶液得到氯化钠固体的操作为蒸发结晶。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目