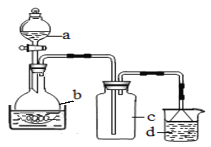
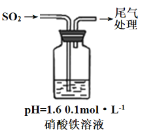
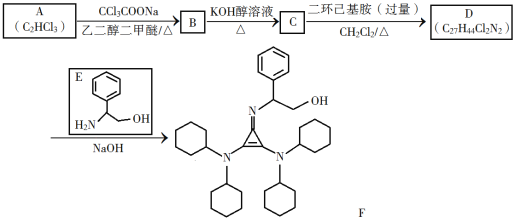
题目内容
【题目】将0.01mol下列物质分别加入l00mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2SO4 ④NaCl
A.①>②>③>④B.①>②>④>③C.①=②>③>④D.①=②>③=④
【答案】D
【解析】
Na2O2与Na2O加入水中发生化学变化,溶液中的溶质是NaOH。
加入物质前后溶液体积变化忽略不计
①Na2O2与水反应的化学方程式为:2Na2O2+2H2O![]() 4Na++4OH-+O2↑,0.01mol Na2O2与水反应生成OH-的物质的量为0.02mol,c(OH-)=0.02mol÷0.1L=0.2 mol·L-1;
4Na++4OH-+O2↑,0.01mol Na2O2与水反应生成OH-的物质的量为0.02mol,c(OH-)=0.02mol÷0.1L=0.2 mol·L-1;
②Na2O与水反应的化学方程式为:Na2O+H2O![]() 2Na++2OH-,0.01mol Na2O与水反应生成OH-的物质的量为0.02mol,c(OH-)=0.02mol÷0.1L=0.2 mol·L-1;
2Na++2OH-,0.01mol Na2O与水反应生成OH-的物质的量为0.02mol,c(OH-)=0.02mol÷0.1L=0.2 mol·L-1;
③0.01mol Na2SO4加入l00mL蒸馏水中,c(SO42-)=0.01mol/0.1L=0.1 mol·L-1;
④0.01mol NaCl加入l00mL蒸馏水中,c(Cl-)=0.01mol÷0.1L=0.1 mol·L-1;
将0.01mol下列物质分别加入l00mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计):①=②>③=④,D正确;
答案选D。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol![]() L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
(3)滴定过程中,眼睛应注视_________________,若用酚酞作指示剂达到滴定终点颜色变化是____________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_____molL-1,烧碱样品的纯度是____(保留小数点后两位)
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____。
② 若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果______________。