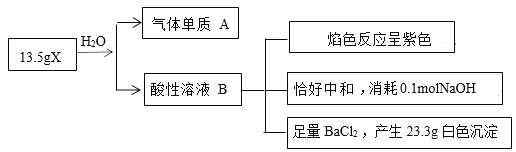
题目内容
【题目】甲醇来源丰富,有广泛的用途和广阔的应用前景,工业上可以利用CO和CO2生产甲醇,同时可以利用甲醇生产丙烯。制备甲醇,丙烯过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.0kJ/mol
CH3OH(g) △H3=-90.0kJ/mol
反应Ⅳ:3CH3OH(g)![]() C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
回答下列问题:
(1)反应Ⅱ的ΔH2=________。
(2)反应Ⅲ能够自发进行的条件是________(填“较低温度”“较高温度”或“任何温度”),据研究该反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于保持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2的生成速率与CH3OH的生成速率相等
D.容器的压强不再变化
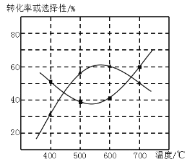
(4)甲醇生产丙烯的同时,还生成乙烯。在某催化剂作用下,2L密闭容器中加入0.5mol甲醇,经过相同时间后测得甲醇转化率及丙烯的选择性(生成丙烯的甲醇与甲醇转化量的比值)与反应温度之间的关系如图所示。计算600℃时反应甲醇生产丙烯的反应Ⅳ平衡常数________。若将容器体积压缩为1L,其他条件不变,在如图中作出甲醇平衡转化率随温度的变化曲线。________。
(5)研究表明,甲醇可由CO2在强酸性水溶液中通过电解合成,则生成甲醇的反应电极反应式:_______。
【答案】+41.0kJ/mol 较低温度 Cu2O+CO![]() 2Cu+CO2 BCD 0.16875
2Cu+CO2 BCD 0.16875  CO2+6e-+6H+=CH3OH+H2O
CO2+6e-+6H+=CH3OH+H2O
【解析】
(1)根据盖斯定律计算待求反应的反应热;
(2)根据反应自发性判断依据分析,从平衡移动角度分析CO2存在对催化剂的影响;
(3)根据平衡状态时任何物质的物质的量、浓度及含量保持不变,分析判断;
(4)根据图示可知反应在600℃时甲醇转化率是60%,根据反应开始时的物质的量浓度,物质的反应关系计算平衡常数,利用该反应的正反应是气体体积增大的反应,增大压强,平衡向气体体积减小的方向移动分析;
(5)根据反应中元素化合价的变化及物质书写电极反应式;
(1)由于反应热与反应途径无关,只与反应的物质的始态和终态有关,所以反应I-反应III,整理可得CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=△H1-△H1=-49.0kJ/mol-(-90.0kJ/mol)=+41.0kJ/mol;
CO(g)+H2O(g) △H2=△H1-△H1=-49.0kJ/mol-(-90.0kJ/mol)=+41.0kJ/mol;
(2)反应III的正反应是气体体积减小的放热反应,根据反应自发进行的判断依据△G=△H-T△S<0,反应可自发进行,则若反应自发进行,由于△H<0,△S<0,所以反应温度要在低温条件下才符合△G<0的条件;
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g)在催化剂Cu2O存在条件下进行,体系中同时存在反应Cu2O+CO
CH3OH(g)在催化剂Cu2O存在条件下进行,体系中同时存在反应Cu2O+CO![]() 2Cu+CO2,若反应体系中含少量CO2,则增大了生成物的浓度,平衡逆向移动,可以产生该反应的催化剂Cu2O,使催化剂的量保持不变,因而可使反应速率可大大加快;
2Cu+CO2,若反应体系中含少量CO2,则增大了生成物的浓度,平衡逆向移动,可以产生该反应的催化剂Cu2O,使催化剂的量保持不变,因而可使反应速率可大大加快;
(3)对于反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的正反应是气体体积减小的放热反应。
CH3OH(g)+H2O(g),该反应的正反应是气体体积减小的放热反应。
A.反应混合物都是气体,气体的质量、体积都不变,因此密度始终不变,因此不能据此判断反应为平衡状态,A错误;
B.反应前后气体的物质的量改变,而气体的质量不变,若混合气体的平均相对分子质量不再变化,说明反应处于平衡状态,B正确;
C.CO2的生成速率与CH3OH的生成速率相等,则任何一种物质的浓度不变,反应达到平衡,C正确;
D.容器的压强不再变化,说明气体的物质的量不变,反应达到平衡状态,D正确;
故合理选项是BCD;
(4)根据图示可知反应在600℃时甲醇转化率是60%,在反应开始时c(CH3OH)=0.25mol/L,达到平衡时c(CH3OH)=0.25mol/L(1-60%)=0.10mol/L,c(C3H6)=0.25mol/L×60%×![]() =0.050mol/L,c(C3H6)=0.25mol/L×60%=0.15mol,则该反应的化学平衡常数K=
=0.050mol/L,c(C3H6)=0.25mol/L×60%=0.15mol,则该反应的化学平衡常数K=![]() =0.16875;由于该反应的正反应是气体体积增大的反应,所以在其它条件不变时,若将容器的体积由2L变为1L,即增大了体系的压强,化学平衡向气体体积减小的逆反应方向移动,导致甲醇平衡转化率降低,用图像表示为:
=0.16875;由于该反应的正反应是气体体积增大的反应,所以在其它条件不变时,若将容器的体积由2L变为1L,即增大了体系的压强,化学平衡向气体体积减小的逆反应方向移动,导致甲醇平衡转化率降低,用图像表示为: ;
;
(5)CO2在酸性条件下,在阴极被还原产生CH3OH,反应方程式为:CO2+6e-+6H+=CH3OH+H2O。

【题目】向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.X和Y可能是

A | B | C | D | |
X | NO2 | SO2 | HCl | Cl2 |
Y | 饱和NaOH溶液 | 饱和碳酸氢钠溶液 | 亚硫酸钠溶液 | 亚硫酸钠溶液 |
A.AB.BC.CD.D