题目内容
12.合成氨工业在现代农业、国防工业中,有着重要的地位已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1
(1)下列有关该反应速率的叙述,正确的是(选填序号)ad.
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$.
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越小.
(3)某温度下,若把10mol N2与30mol H2 置于体积为10L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=$\frac{1}{12}$(可用分数表示).
(4)对于合成氨反应而言,如图有关图象一定正确的是(选填序号)ac.
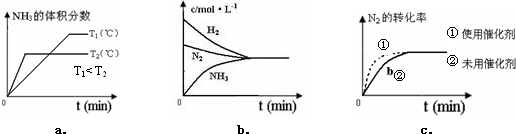
分析 (1)a.升高温度可以增大活化分子百分数,导致加快反应速率;
b.增大压强不能增大活化分子百分数,但增大单位体积内活化分子个数,所以可以加快反应速率;
c.使用催化剂可以降低活化能,加快反应速率;
d.反应物接触面积越大,其反应速率越快;
(2)①化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$;
②该反应的正反应是放热反应,升高温度平衡逆向移动,平衡常数减小;
(3)N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,$\frac{2x}{1-x+3-3x+2x}$×100%=20%,
解得x=$\frac{1}{3}$,根据K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$进行计算;
(4)a.升高温度,平衡逆向移动,则氨气的体积分数减小;
b.反应到达平衡时,各物质浓度变化量之比等于其计量数之比;
c.使用催化剂加快反应速率,缩短反应时间,但不影响平衡移动.
解答 解:(1)a.升高温度可以增大活化分子百分数,有效碰撞的次数增加,则加快反应速率,故a正确;
b.增大压强,可增大单位体积活化分子数目,则加快反应速率,故b错误;
c.使用催化剂,降低反应的活化能,加快反应速率,但反应物分子平均能量不变,故c错误;
d.增大固体表面积,可增大反应速率,故d正确,
故答案为:ad;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$,故答案为:$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$;
②该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,故答案为:小;
(3)N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,$\frac{2x}{1-x+3-3x+2x}$×100%=20%,
解得x=$\frac{1}{3}$,K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$=$\frac{(\frac{2}{3})^{2}}{\frac{2}{3}×{2}^{3}}$=$\frac{1}{12}$,
故答案为:$\frac{1}{12}$;
(4)a.升高温度,平衡逆向移动,则氨气的体积分数减小,但反应到达平衡的时间缩短,故正确;
b.反应到达平衡时,各物质浓度变化量之比等于其计量数之比,氢气与氨气浓度变化量之比为3:2,故错误;
c.使用催化剂加快反应速率,缩短反应时间,但不影响平衡移动,符合题意,故正确;
故选ac.
点评 本题考查较综合,涉及化学平衡及常数的有关计算、平衡及反应速率影响因素等知识点,侧重考查学生分析判断及计算能力,这些都是高频考点,注意催化剂只影响反应速率不影响平衡移动,题目难度中等.

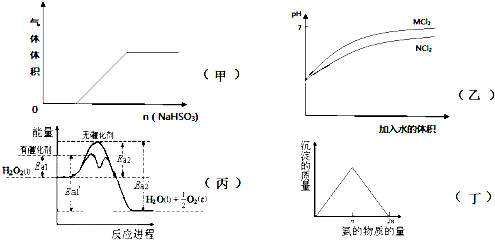
| A. | 甲是亚硫酸氢钠粉末投入稀硝酸溶液中的有关图象 | |
| B. | 乙是等pH的MCl2和NCl2溶液稀释时pH变化图象,由此可推测M的金属性较强 | |
| C. | 由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)═2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ•mol-1 | |
| D. | 丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图象 |
| A. | 乙醇汽油比普通汽油保质期长 | |
| B. | 使用乙醇汽油可减少大气雾霾 | |
| C. | 区别两者可用测沸点的方法,普通汽油沸点高 | |
| D. | 区别两者可加入水中,只有普通汽油能分层 |
| A. | 在Na2SO4溶液中滴入Ba(OH)2溶液,产生白色沉淀:Ba2++SO42-=BaSO4↓ | |
| B. | 向H2O中加入少量Na2O2,产生无色气体:2Na2O2+2H2O=O2↑+4OH-+4Na+ | |
| C. | 向Cl2水中滴入适量Fe(NO3)2 溶液,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I-+2H+=I2+2H2O |
| A. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 装饰材料释放的甲醛会造成污染 |
 H2S+2OH-
H2S+2OH- AlO2-+H++H2O,K=2.0×10-13。则Al(OH)3溶于NaOH溶液反应的平衡常数数值为
AlO2-+H++H2O,K=2.0×10-13。则Al(OH)3溶于NaOH溶液反应的平衡常数数值为
 、
、 ;
; .
.