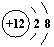题目内容
(1)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).回答下列问题:
①溶液中存在的离子是;
②写出溶液中加入过量的稀硫酸反应的离子方程式.
(2)CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等,写出CNO-在酸性条件下被NaClO氧化的离子方程式:________。
(3)酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
①向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,反应的化学方程式________________。
②取300mL0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
③在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.

(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)测定液态氟化氢的相对分子质量,实验值大于20,原因是存在因氢键形成的缔合分子(HF)n.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:
请比较二者酸性强弱:HIO3>H5IO6(填“>”、“<”或“=”),原因是碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸
(5)BCl3是一种非金属氯化物,其分子中B-Cl键的键角为120°,写出一种与BCl3互为等电子体的离子CO32-.
(6)如图3为碘晶体晶胞结构.有关说法中正确的是.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(如图4)的密度为pg/cm3,NA为阿伏伽德罗常数.
①阳离子的配位数为8.
②晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm(用含p、NA的代数式表示)

(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)测定液态氟化氢的相对分子质量,实验值大于20,原因是存在因氢键形成的缔合分子(HF)n.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
请比较二者酸性强弱:HIO3>H5IO6(填“>”、“<”或“=”),原因是碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸
(5)BCl3是一种非金属氯化物,其分子中B-Cl键的键角为120°,写出一种与BCl3互为等电子体的离子CO32-.
(6)如图3为碘晶体晶胞结构.有关说法中正确的是.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(如图4)的密度为pg/cm3,NA为阿伏伽德罗常数.
①阳离子的配位数为8.
②晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm(用含p、NA的代数式表示)
9.下列反应与4H2O2+PbS→PbSO4+4H2O相比较,H2O2的作用相同的是( )
| A. | H2O2+SO2→H2SO4 | |
| B. | 3H2O2+2NaCrO2+2NaOH→2Na2CrO4+4H2O | |
| C. | 2H2O2→2H2O+O2↑ | |
| D. | H2O2+2FeCl3→2FeCl2+2HCl+O2↑ |


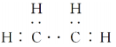
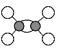
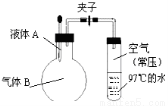
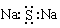
 H++ClO4-
H++ClO4-